Onthulling van het mysterie van de kleine molecuul WA: licht werpen op de regulering van PHGDH-enzymen en de weg vrijmaken voor nieuwe anti-kankertherapieën
Serine, een onmisbaar aminozuur, vervult verschillende cruciale biologische functies in levende organismen. Het dient niet alleen als een fundamenteel onderdeel van de eiwitsynthese, maar neemt ook deel aan de regulatie van talrijke metabolische routes, waaronder de nucleotidesynthese, het methioninemetabolisme en antioxiderende functies. Van deze routes heeft fosfopyruvaatdehydrogenase (PHGDH) een cruciale betekenis omdat het de eerste stap van de serinesyntheseroute katalyseert, waarbij 3-fosfoglyceraat wordt omgezet in 3-fosfohydroxypyruvaat. Gezien de centrale rol ervan in het serinemetabolisme, is elke afwijking in de PHGDH-functie nauw verbonden met het ontstaan en de progressie van talrijke ziekten, met name kanker.
Dit artikel introduceert een innovatieve aanpak die gebruik maakt van chemische proteomics en fenotypische analysetechnieken om een verbinding te identificeren die in staat is PHGDH covalent te remmen. Hoewel de meeste PHGDH-remmers doorgaans competitief van aard zijn, presenteren de auteurs Withangulatin A (WA), een natuurlijk klein molecuul, als een nieuwe covalente remmer van PHGDH. WA komt naar voren als een veelbelovende lead compound voor de ontwikkeling van PHGDH-remmers. Bovendien dient WA als een waardevolle probe voor het onderzoeken van de functionaliteit van PHGDH en de serinesyntheseroute (SSP). Door gebruik te maken van deze remmer krijgen onderzoekers dieper inzicht in de regulerende mechanismen die het serinemetabolisme beheersen, waardoor mogelijkheden worden geopend voor het onderzoeken van mogelijke behandelingsmodaliteiten voor gerelateerde ziekten, met name kanker.
Deze ontdekking biedt niet alleen veelbelovende richtingen voor de ontwikkeling van nieuwe medicamenteuze behandelingsstrategieën, maar levert ook cruciale inzichten op in de rol van het serinemetabolisme bij de progressie van de ziekte.
Onderzoeksroute
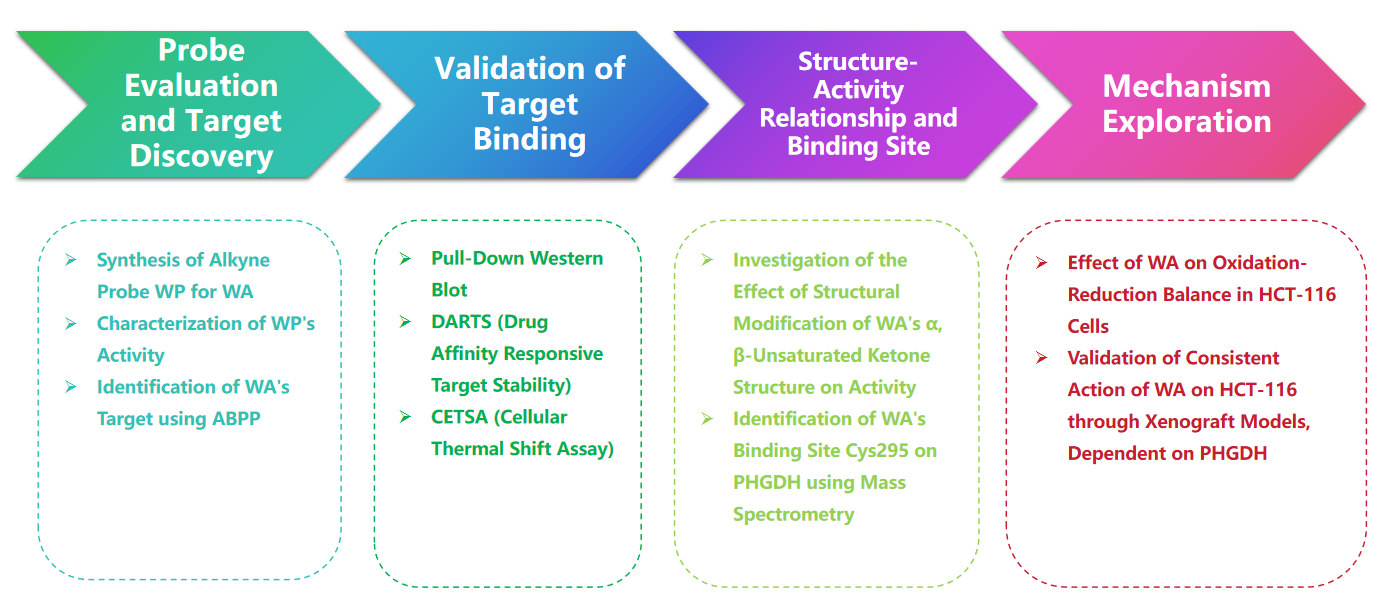
Experimenteel proces
1. Vergelijking van WP en WA in de cytotoxiciteitsexperimenten.
In het onderzoek bedacht en synthetiseerde de auteur een samengestelde probe genaamd WP. Met behulp van menselijke darmkankercellen (HCT-116) en normale darmcellen (NCM460) constateerden de auteurs dat WP een vergelijkbare cytotoxiciteit vertoonde als WA. Dit suggereert dat de opname van alkynmarkers de cytotoxische effecten ervan niet significant veranderde. Bovendien merkten de auteurs op dat WA een lagere cytotoxiciteit vertoonde in normale darmcellen, maar een hogere cytotoxiciteit in darmkankercellen, wat de verhoogde selectiviteit ervan ten aanzien van darmkankercellen onderstreepte.
Vervolgens gebruikten de auteurs een Activity-Based Protein Profiling (ABPP)-strategie, waarbij gebruik werd gemaakt van de WP-sonde in HCT-116-cellen. Deze aanpak leidde tot de identificatie van PHGDH als een direct doelwiteiwit van WA. Experimentele validatie werd uitgevoerd met behulp van WB-pull-down-assays, die de bevindingen bevestigden.
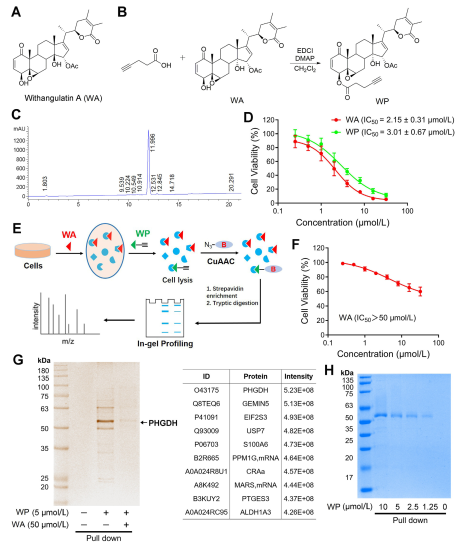
Figuur 1: Chemische Proteomics-benadering om doelen van Withangulatin A te identificeren.
2. Bevestiging van directe interactie tussen WA en PHGDH.
Met behulp van Activity-Based Protein Profiling (ABPP)-technologie identificeerden de auteurs PHGDH als een direct doelwit van samengestelde WA in HCT-116-cellen. Om de interactie tussen WA en PHGDH te valideren, voerden de auteurs experimenten met Drug Affinity Responsive Target Stability (DARTS) en Cellular Thermal Shift Assay (CETSA) uit. De resultaten toonden aan dat WA de thermische stabiliteit van PHGDH verbeterde en de activiteit ervan aanzienlijk remde. Bovendien leverden experimenten met Biolayer Interferometry (BLI) verdere bevestiging van de directe interactie tussen WA en PHGDH.
De auteurs onderzochten ook de onomkeerbare aard van WA-binding aan PHGDH. Uit hun experimenten bleek dat PHGDH WP-binding verhinderde; pre-incubatie met oplossingen die N-acetylcysteïne (NAC) of glutathion (GSH) bevatten, zou echter de binding van WP aan PHGDH kunnen omkeren. Deze bevindingen suggereren een onomkeerbare covalente binding tussen WA en cysteïneresiduen in het PHGDH-eiwit.
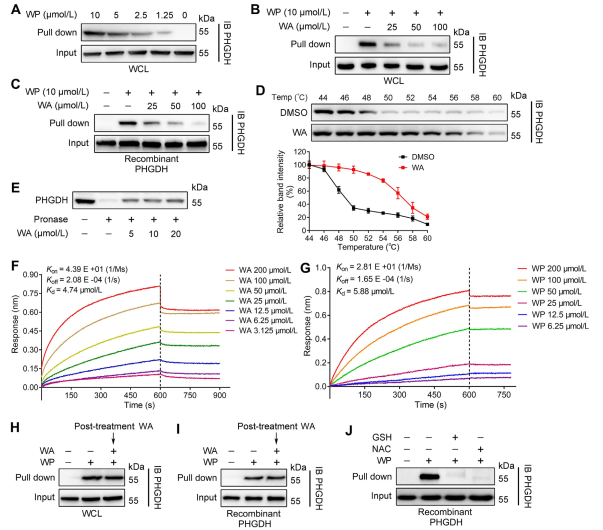
Figuur 2: WA bindt rechtstreeks aan PHGDH.
3. WA bindt covalent aan PHGDH via de α - β-onverzadigde ketongroep.
Om het mechanisme waarmee WA interageert met PHGDH verder te verduidelijken, voerden de onderzoekers experimenten uit om de covalente binding van WA aan PHGDH via zijn α-β-onverzadigde ketonstructuur te bevestigen. Aanvankelijk werden WA's α,β-onverzadigde ketonfragmenten gereduceerd om WA-1 te produceren (zie Deel Figuur 3A). Daaropvolgende analyses met behulp van Cell Counting Kit-8 (CCK-8)-testen en Pull-down-eiwitinteractietesten (zie Figuur 3B) toonden aan dat het cytotoxische effect van WA inderdaad afhankelijk was van de α- en β-onverzadigde ketonstructuur. Omgekeerd slaagde WA-1 er niet in om effectief de binding van PHGDH aan WP te voorkomen (zie Figuur 3C en D), waardoor de covalente binding van het β-onverzadigde keton aan PHGDH verder werd bevestigd (zie Figuur 3E).
Gezien de significante rol van PHGDH-remming of afwezigheid bij het blokkeren van processen van de serinesyntheseroute (SSP) in tumorcellen, gingen de auteurs verder met het onderzoeken van het effect van WA op SSP-activiteit in HCT-116-cellen met behulp van U-13C-glucose-stabiele isotooplabeling (zie naar Figuur 3J). Experimentele resultaten onthulden dat WA de SSP-activiteit in HCT-116-cellen effectief remde.
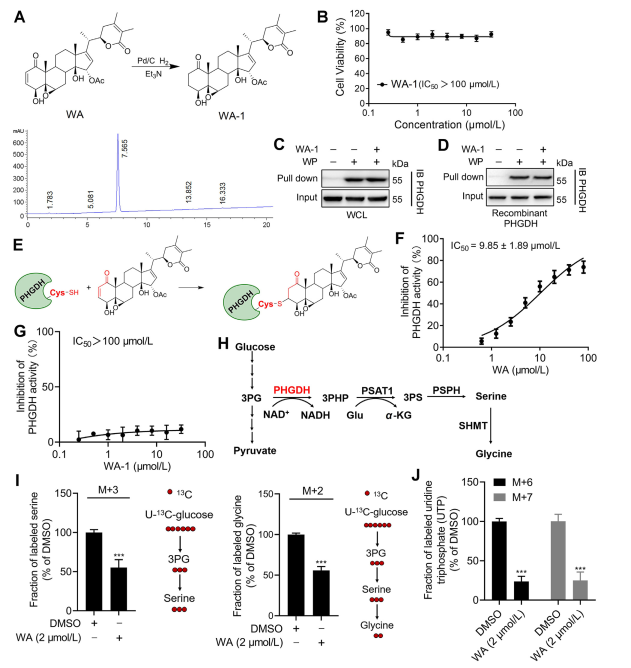
Figuur 3: WA bindt covalent aan PHGDH en remt de PHGDH-activiteit.
4. Het Cys295-residu van PHGDH is covalent gebonden aan WA.
Theoretisch kunnen de α- en β-onverzadigde ketongroepen van WA een covalente binding vormen met cysteïneresiduen van het eiwit. De auteurs hebben inderdaad covalente modificatie van de Cys295-residuen in PHGDH door WA waargenomen. Vervolgens leverden ze verder bewijs van de covalente binding van WA aan de Cys295-residuen van PHGDH en toonden ze aan dat mutaties op Cys295 de remmende activiteit van WA op PHGDH aanzienlijk verminderden. Bovendien onthulden experimenten met Biolayer Interferometry (BLI) geen interactie tussen WA en recombinant Cys295A PHGDH-eiwit, wat de selectieve covalente binding van WA aan PHGDH bevestigt.
Bovendien gaven moleculaire dynamica-simulaties aan dat WA functioneert als een allosterische regulator van PHGDH, waarbij het Cys295-residu mogelijk kan dienen als een nieuwe allosterische plaats voor PHGDH.
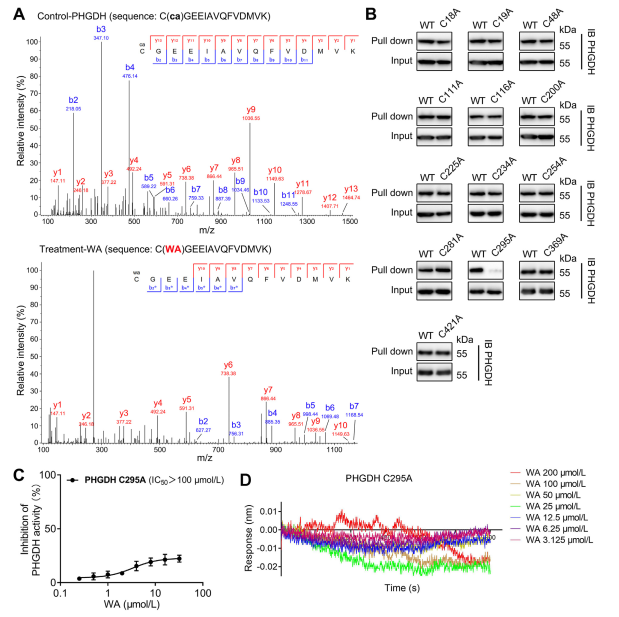
Figuur 4. WA bindt selectief covalent aan de Cys295-residuen van PHGDH.
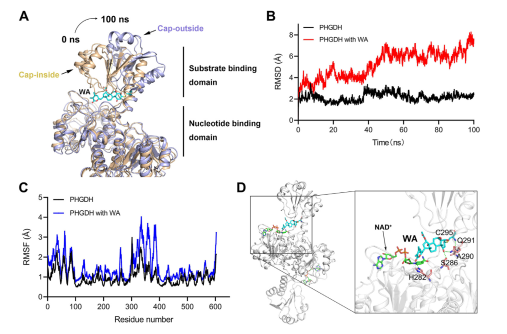
Figuur 5: Cys295-residu als de allosterische regulerende plaats van PHGDH
5. Het effect van WA op de Redox-balans in HCT-116-cellen.
De serinesyntheseroute (SSP) speelt een cruciale rol bij het handhaven van de cellulaire redoxbalans door voorlopers te leveren voor de synthese van glutathion (GSH) en de productie van NADPH, essentieel voor redoxreacties. De auteurs onderzochten de impact van WA op de redoxbalans in HCT-116-cellen en merkten op dat WA leidde tot verhoogde niveaus van reactieve zuurstofsoorten (ROS), waardoor de GSH/GSSG- en NADPH/NADP+-verhoudingen werden verlaagd, wat indicatief is voor verhoogde oxidatieve stress.
Western blot-analyse onthulde verhoogde expressie van γ H2AX, gesplitst caspase3 en gesplitst PARP, samen met verminderde CHK2- en cycline D1-expressie, wat duidt op inductie van apoptose door WA. Bovendien resulteerde verlies van PHGDH in verhoogde ROS-productie, remde de proliferatie van HCT-116-cellen en verminderde cytotoxiciteit van WA in cellen met lage PHGDH-expressie. Deze bevindingen onderstrepen de rol van PHGDH bij de ROS-productie en WA-gemedieerde cytotoxiciteit in HCT-116-cellen.
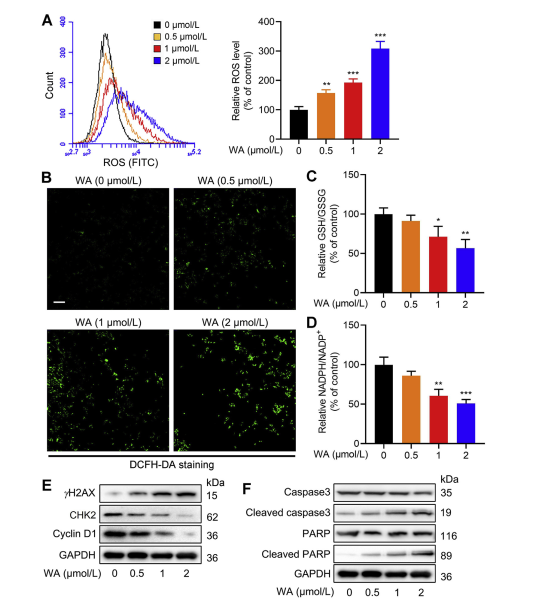
Figuur 6: WA verhoogt de intracellulaire ROS-niveaus in HCT-116-cellen
6. Celproliferatie-effect in xenotransplantaatmodellen.
Om de impact van WA op de proliferatie van HCT-116-cellen in vivo te beoordelen, hebben de auteurs een xenotransplantaatmodel opgesteld met behulp van HCT-116-cellen. Uit de resultaten bleek dat WA geen significante effecten op het lichaamsgewicht of de orgaanmorfologie vertoonde, wat wijst op een lage toxiciteit.
Om de selectiviteit van WA voor PHGDH-remming verder te onderzoeken, genereerden de auteurs een xenotransplantaatmodel met behulp van PHGDH knock-out (KO) HCT116-cellen. In dit model remde de afwezigheid van PHGDH de proliferatie van HCT-116-cellen aanzienlijk (zie Figuur 7, AC). Bovendien was de expressie van Ki67, een marker van celproliferatie, significant verminderd in het PHGDH KO HCT116 celxenotransplantaatmodel (zie Figuur 7, D).
Met name in het xenotransplantaatmodel waarbij PHGDH KO HCT-116-cellen werden gebruikt, vertoonde WA geen significant remmend effect op celproliferatie (zie Figuur 7, EG), wat verder bevestigt dat het remmende effect van WA op HCT-116-cellen afhankelijk was van PHGDH.
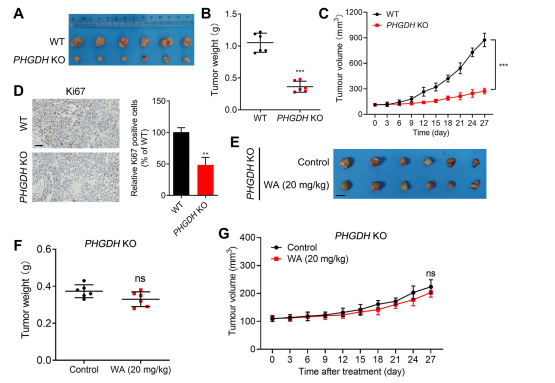
Figuur 7: Effect van WA op de proliferatie van PHGDH KO HCT-116-cellen in vivo
De resultaten van deze studie bieden niet alleen belangrijke aanwijzingen voor de toekomstige ontwikkeling van geneesmiddelen tegen kanker voor PHGDH, maar brengen ook nieuwe hoop en potentieel voor de ontwikkeling van nieuwe geneesmiddelen op het gebied van kankertherapie.
Referentie:https://doi.org/10.1016/j.apsb.2021.06.008

