Analiza ABPP ujawnia nowy mechanizm przeciwzapalny kwasu itakonowego poprzez interakcje białko-metabolit
Itakonian, endogenny metabolit kluczowy dla stanu zapalnego i regulacji układu odpornościowego, został wyjaśniony we wspólnym artykule zespołu ChomiX Biotech. W badaniu w innowacyjny sposób wykorzystano technologię ABPP, aby wykazać, że itakonian modyfikuje S-glikozylację reszt cysteiny na kluczowych enzymach glikolitycznych, wpływając w ten sposób na metabolizm komórkowy. Naukowcy zmapowali interakcje białko-itakonian i odkryli, że itakonian bezpośrednio wiąże i reguluje wiele enzymów na szlaku glikolizy, wpływając na jego szybkość i kierunek. Badanie to poszerza naszą wiedzę na temat mechanizmów kontroli metabolicznej podczas zapalenia związanego z chorobą i pokazuje siłę ABPP w badaniu, w jaki sposób małe cząsteczki modulują funkcje białek. Jako lider w proteomice chemicznej, Corolus BioScience oferuje kompleksowe rozwiązania, w tym projektowanie sond, przetwarzanie próbek, wysokowydajne badania przesiewowe i analizę danych, aby pomóc klientom odkryć podobne mechanizmy metaboliczno-regulacyjne.
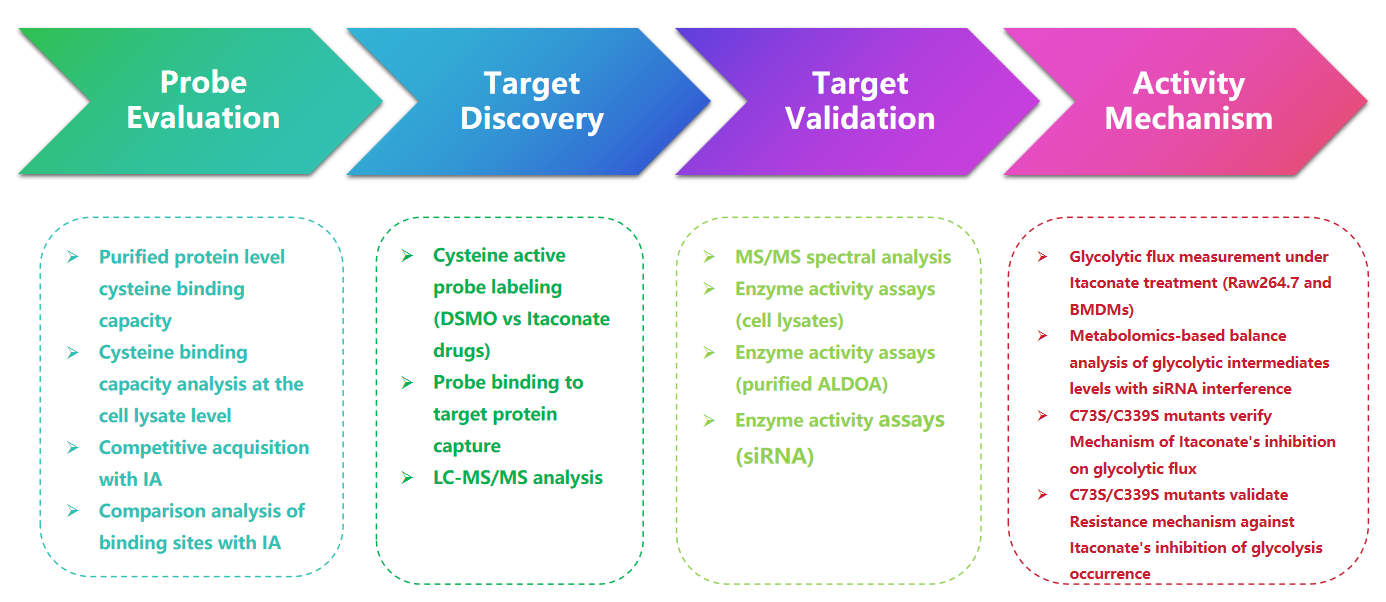
1. Wykrywanie modyfikacji itakonatu za pomocą sondy 1-OH-Az
W tym badaniu autorzy zastosowali zaawansowane techniki profilowania w celu zbadania reszt cysteiny ukierunkowanych na itakonian. Początkowo ocenili sondę 1-OH-Az za pomocą elektroforezy żelowej i przeprowadzili konkurencyjne eksperymenty z użyciem IA-alkinu. Walidacja spektrometrią mas potwierdziła, że 1-OH-Az selektywnie znakuje miejsca cysteinowe, przy czym 87% nowo zidentyfikowanych białek nie zostało wcześniej udokumentowanych jako białka wiążące ligand w DrugBank. Biorąc pod uwagę różnorodne funkcje i znaczenie chorobowe tych białek, sondę 1-OH-Az można zastosować do identyfikacji aktywnych cystein jako potencjalnych celów leków dla nowych środków terapeutycznych.
Rycina 1: 1-OH-Az jako wydajna i charakterystyczna sonda do analizy cysteiny do wykrywania modyfikacji itakonianu
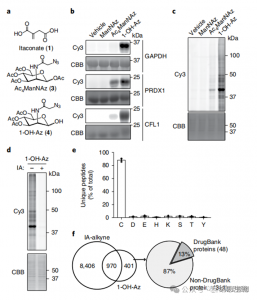
2. Identyfikacja miejsc modyfikacji Itaconate przy użyciu ilościowych technik proteomicznych
Naukowcy przeprowadzili eksperymenty isoTOP-ABPP w celu ilościowego określenia reszt cysteiny modyfikowanych itakonianem przy użyciu sondy 1-OH-Az. Po wstępnej obróbce lizatem wykorzystano znakowaną izotopowo proteomikę ilościową wspomaganą łącznikiem do analizy wpływu różnych stężeń itakonianu, wskazując jego specyficzne cele. Przeprowadzono także eksperymenty porównawcze przy użyciu dwóch stężeń IA-alkinu, które, choć wykazały szerszą aktywność i zasięg, rozpoznały jedynie 65 i 50 skutecznie konkurencyjnych miejsc. Warto zauważyć, że 1-OH-Az wykazał znacznie większą przewagę konkurencyjną wśród wspólnie oznaczanych ilościowo cystein.
Rycina 2: Chemiczna analiza proteomiczna cystein modyfikowanych itakonianem z wykorzystaniem konkurencyjnego izoTOP-ABPP z 1-OH-Az
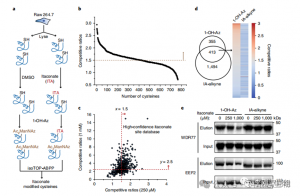
3. Itaconate modyfikuje i hamuje kluczowy enzym glikolityczny
Analiza spektrometrii mas wykazała, że itakonian modyfikuje trzy kluczowe enzymy glikolityczne: ALDOA, GAPDH i LDHA. Endogenną modyfikację itakonianu na Cys73 i Cys339 ALDOA potwierdzono w komórkach Raw264.7 stymulowanych LPS. Ze względu na bliskość autorzy spekulują, że takie modyfikacje mogą wpływać na aktywność aldolazy. Rzeczywiście, traktowanie 1 mM itakonianem prowadziło do zmniejszonej aktywności enzymu ALDOA bez wpływu na ekspresję białka. Ponadto analizy isoTOP-ABPP wykazały, że Cys84 na LDHA i Cys245 na GAPDH są również celami modyfikacji itakonianu.

Rysunek 3: Itaconate może modyfikować i osłabiać funkcję ALDOA
4. Itakonian głównie hamuje glikolizę poprzez celowanie w ALDOA
Aby ocenić regulacyjną rolę ITAC w zapalnej glikolizie makrofagów, autorzy monitorowali zużycie glukozy i wytwarzanie mleczanu w komórkach Raw264.7 przed i po stymulacji LPS, wykazując, że ITAC znacząco zmniejszył oba te czynniki, co wskazuje na supresję funkcji glikolitycznej. Aby potwierdzić wpływ ITAC na ALDOA i późniejsze hamowanie glikolizy, znokautowano endogenną ALDOA przy użyciu RNAi i nadekspresję ALDOA WT lub podwójnie mutanta (C73S/C339S) w komórkach Raw264.7. Zgodnie z oczekiwaniami, wyłączenie ALDOA spowodowało zmniejszenie zużycia glukozy i produkcji mleczanu, czyniąc komórki niewrażliwymi na leczenie ITAC. Ponowne wprowadzenie WT lub zmutowanego ALDOA przywróciło poziom metaboliczny w nietraktowanych komórkach; jednakże komórki z nadekspresją zmutowanego ALDOA wykazywały zmniejszoną wrażliwość na hamowanie glikolityczne w porównaniu z WT. Testy enzymatyczne na aktywność aldolazy dostosowane do stanów glikolitycznych.
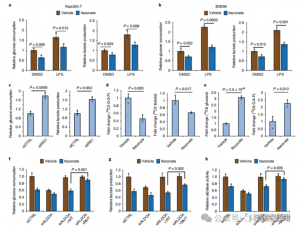
Rycina 4: Itakonian zmienia szlak glikolityczny poprzez modyfikację ALDOA
5. Hamowanie ALDOA przyczynia się do reakcji przeciwzapalnych
Odkrycia te ujawniły, że ITAC hamuje aktywność szlaku glikolitycznego poprzez modyfikację reszt cysteinowych Cys73 i Cys339 na ALDOA. Autorzy wywnioskowali dalej ze znanego przeciwzapalnego działania fumaranu dimetylu poprzez modyfikację cysteiną na GAPDH i hamowanie glikolityczne, że ITAC może podobnie reagować ze sprzężeniem zwrotnym, zakłócając glikolizę i wywierając działanie przeciwzapalne. Powalenie ALDOA znacząco zmniejszyło wydzielanie IL-1β po stymulacji LPS, co sugeruje jego udział w regulacji stanu zapalnego poprzez glikolizę. Częściowe odwrócenie przeciwzapalnego działania knockdown ALDOA za pomocą uzupełnionego pirogronianu wskazało na ograniczoną rolę LDHA w odpowiedziach zapalnych.
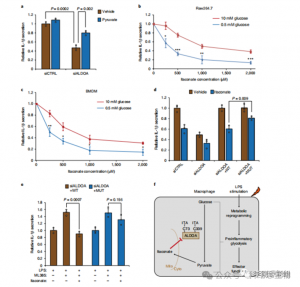
Rycina 5: Przeciwzapalne działanie itakonianu odbywa się poprzez hamowanie ALDOA, co powoduje zaburzenie glikolizy
Podsumowując, w artykule skutecznie wykorzystano technologie profilowania cysteiny oparte na S-glikozylacji i metodologie ABPP w celu skonstruowania sieci interakcji między itakonianem i pokrewnymi białkami. W przekonujący sposób pokazuje, że itakonian służy jako krytyczny regulator metabolizmu poprzez specyficzną modyfikację reszt cysteiny w białkach w celu kontrolowania szlaku glikolitycznego. Badanie to nie tylko wyjaśnia mechanizm działania itakonianu jako nowego regulatora metabolizmu, ale także dostarcza solidnych dowodów na to, w jaki sposób małe metabolity oddziałują z białkami, modulując podstawowe szlaki metaboliczne.
Oprócz ABPP inne metody badania interakcji między drobnocząsteczkowymi metabolitami i białkami obejmują między innymi:
1. Wzbogacanie powinowactwa (rozwijanie)techniki, w których natywny związek przekształca się w biotynylowaną sondę, która inkubuje z lizatami komórkowymi, a następnie następuje wzbogacanie za pośrednictwem streptawidyny i izolacja celów białkowych, które wiążą się z sondą biotynową.
2.Spektrometria mas z ograniczoną proteolizą (LiP-MS)to technologia odkrywania celów oparta na powinowactwie białek. Kiedy określone ligandy, takie jak leki lub małe cząsteczki, wiążą się z określonymi białkami, indukują zmiany konformacyjne lub przeszkody przestrzenne, prowadzące do zróżnicowanych miejsc rozszczepienia w porównaniu z niezwiązanym białkiem. Wykrywając te różnice za pomocą spektrometrii mas, metoda ta może zidentyfikować interakcje leku z białkiem w komórkach i określić cele molekularne leku.
3.Test komórkowego przesunięcia termicznego (CETSA)został pierwotnie opracowany, aby pomóc w badaniach nad celami leków przeciwnowotworowych i jest jedną z pierwszych powszechnie stosowanych, pozbawionych etykiet metod badania zaangażowania celu leku w nienaruszonych komórkach. CETSA opiera się przede wszystkim na zasadzie, że po związaniu się z docelowym białkiem związek zwiększa swoją stabilność termiczną. Po inkubacji próbek ze związkiem i odpowiednimi kontrolami w różnych gradientach temperatury, białka związane z ligandem pozostają pofałdowane i względnie stabilne po podgrzaniu, podczas gdy niezwiązane białka rozwijają się i wytrącają w wyniku denaturacji. Późniejsza analiza termostabilności rozpuszczalnych białek metodą immunoblottingu lub spektrometrii mas, w oparciu o ich krzywe topnienia, potwierdza interakcję między związkiem a białkami wewnątrzkomórkowymi.
4. Chromatografia powinowactwapolega na koniugowaniu docelowego metabolitu z matrycą w fazie stałej w celu wychwytywania kompleksów białkowych, które z nim oddziałują. Wychwycone białka są następnie identyfikowane za pomocą technik takich jak spektrometria mas.
5.Powierzchniowy rezonans plazmonowy (SPR)służy do pomiaru w czasie rzeczywistym, bez etykiet, parametrów kinetycznych związanych z interakcjami pomiędzy małymi cząsteczkami i białkami.
6. Krystalografia białekwyjaśnia trójwymiarowe struktury białek skompleksowanych z drobnocząsteczkowymi ligandami, zapewniając intuicyjny wgląd w miejsca wiązania i mechanizmy działania. Rozwiązując te struktury, badacze mogą bezpośrednio wizualizować, w jaki sposób małe cząsteczki oddziałują z docelowymi białkami.

