Wykorzystanie proteomiki chemicznej do identyfikacji celu funkcjonalnego SLC25A20 mebutynianu ingenolu w leczeniu rogowacenia słonecznego
W badaniu tym wykorzystano proteomikę chemiczną do odkrycia nowego celu dla butylanu metylu makromorolu (Ing-Meb), leku stosowanego w leczeniu rogowacenia słonecznego. Zespół badawczy początkowo opracował i zsyntetyzował sondę fotopowinowactwa Ing-Meb o nazwie Ing-Dayne, która tworzy wiązania kowalencyjne z białkami docelowymi po ekspozycji na światło UV, ułatwiając identyfikację potencjalnych celów funkcjonalnych. W wyniku późniejszej walidacji autorzy zidentyfikowali SLC25A20 jako kluczowy cel Ing-Meb. SLC25A20 to związana z błoną mitochondrialną translokaza karnityno-acylokarnityna zaangażowana w metabolizm kwasów tłuszczowych. W szczególności hamujące działanie Ing-Meb na funkcję SLC25A20 prowadzi do zwiększonej akumulacji długołańcuchowych acylokarnityn, co potwierdza, że Ing-Meb wywołuje działanie terapeutyczne poprzez modulowanie szlaku utleniania kwasów tłuszczowych. Ponadto w badaniu zgłębiono znaczenie modyfikacji strukturalnych w badaniach produktów naturalnych. Syntetyzując sondę fotopowinowactwa Ing-Dayne'a poprzez modyfikację strukturalną Ing-Meb, badaczom udało się odkryć nowy cel różniący się od konwencjonalnego zrozumienia. To nie tylko zwiększa zrozumienie Ing-Meb i jego sposobu działania, ale także podkreśla kluczową rolę modyfikacji strukturalnych w badaniach proteomiki chemicznej w odkrywaniu złożoności produktów naturalnych. Takie spostrzeżenia dodatkowo napędzają innowacje w zakresie leków, obejmujące optymalizację skuteczności istniejących leków, rozwój nowych terapii ukierunkowanych na określone jednostki chorobowe oraz wyjaśnienie mechanizmów skutków ubocznych leków.
Trasa Badawcza
Proces eksperymentalny
1. Zaprojektowanie syntetycznej sondy fotopowinowactwa Ing-Dayne'a odkrywa mechanizm leżący u podstaw wiązania leku Ing-Meb na rogowacenie słoneczne z docelowym białkiem.
W tym badaniu zastosowano sondę powinowactwa Ing-Dayne, pochodzącą z leku leczniczego Ing-Meb na rogowacenie słoneczne (patrz Ryc. 1). Poprzez wspólną hodowlę cząsteczki sondy ze specyficznymi komórkami i późniejsze napromienianie światłem UV, podwójna struktura akrydyny w sondzie utworzyła stabilne wiązania kowalencyjne z białkami wewnątrzkomórkowymi. Po lizie komórek reakcja chemiczna Click ułatwiła przyłączenie grupy reporterowej azydku-tetrametylorodaminy do białka docelowego (jak pokazano na Figurze 2). Późniejsza analiza SDS-PAGE (przedstawiona na Figurze 3) ujawniła, że Ing-Meb wykazywał znaczący efekt wiązania kompetycyjnego z sondą, podczas gdy Ingenol, posiadający podobną strukturę, nie wykazywał hamowania kompetycyjnego.
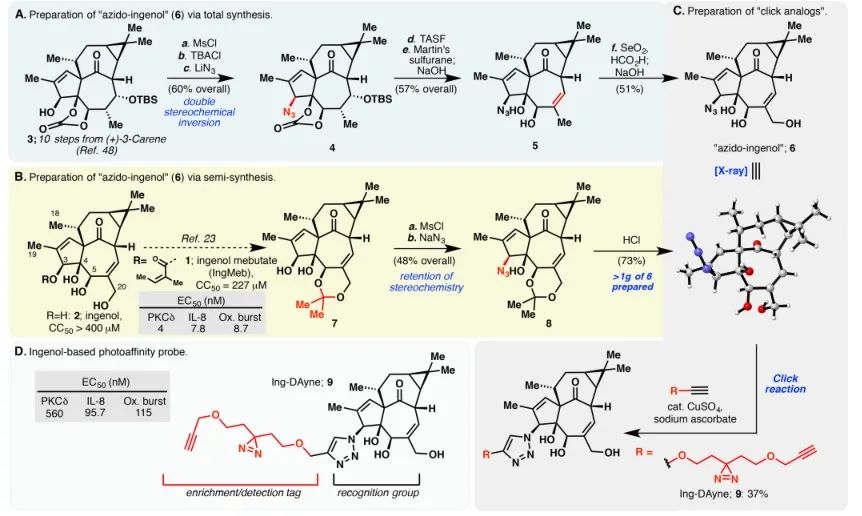
Rysunek 1: Ilustruje dwie drogi syntezy zastosowane w syntezie Ing-Dayne'a.
2. Nowatorska sonda 11b zidentyfikowała 44 białka docelowe BBR związane ze stanem zapalnym w komórkach THP-1 i ujawniła, że EIF2AK2, eEF1A1, PRDX3 i VPS4B są bezpośrednimi celami ze specyficznymi interakcjami z BBR.
Autorzy, w drodze serii eksperymentów, z powodzeniem zastosowali nową sondę 11b do znakowania i oczyszczania potencjalnych białek docelowych w komórkach THP-1. Następnie wykorzystali analizę LC-MS/MS do zidentyfikowania 44 białek związanych ze stanem zapalnym w zakresie masy cząsteczkowej od 20 do 80 kDa, spośród których sześć potencjalnie odgrywało kluczową rolę w działaniu przeciwzapalnym BBR. W dalszych badaniach potwierdzono, że EIF2AK2, eEF1A1, PRDX3 i VPS4B są bezpośrednimi celami BBR, wykazując konkurencyjne działanie hamujące przy wysokich stężeniach leczenia BBR. Odkrycie to ujawniło prawdopodobne istnienie specyficznych interakcji pomiędzy tymi białkami i BBR, wyjaśniając w ten sposób nowe spostrzeżenia na temat ich zaangażowania w lek podczas jego procesów przeciwzapalnych.
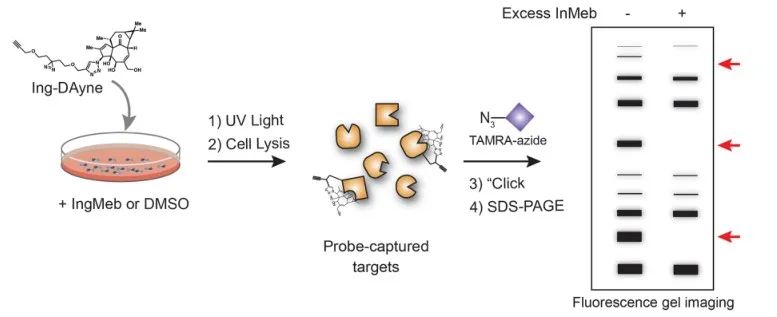
Rysunek 2: Proces walidacji celu Ing-Dayne'a w oparciu o żel.
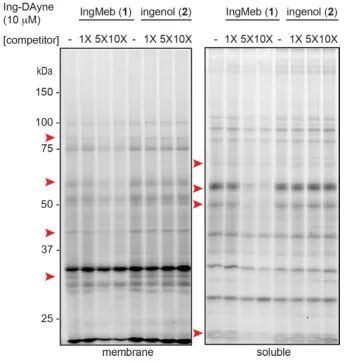
Rycina 3: Konkurencyjne hamowanie Ing-Meb i ingenolu na cząsteczce sondy Ing-Dayne.
3. Badanie przesiewowe SILAC, połączone z walidacją Western blot, zidentyfikowało SLC25A20 jako główny cel leku klasy Ingenol Ing-Meb.
Autorzy początkowo przebadali 28 potencjalnych białek docelowych, stosując technologię znakowania stabilnych izotopów za pomocą aminokwasów w hodowli komórkowej (SILAC) (Rysunek 4). Następnie, w drodze dalszych badań przesiewowych i eksperymentów walidacyjnych metodą Western blot (ryc. 5), badacze zaobserwowali, że Ing-Meb wykazywał najsilniejsze działanie hamujące na SLC25A20 spośród tych kandydatów na cele, co silnie sugeruje, że SLC25A20 jest jednym z głównych celów funkcjonalnych Ing-Meb.
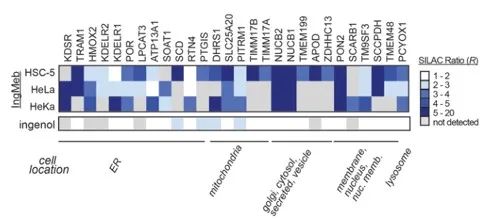
Rysunek 4: 28 potencjalnych celów uzyskanych w wyniku wstępnej selekcji.
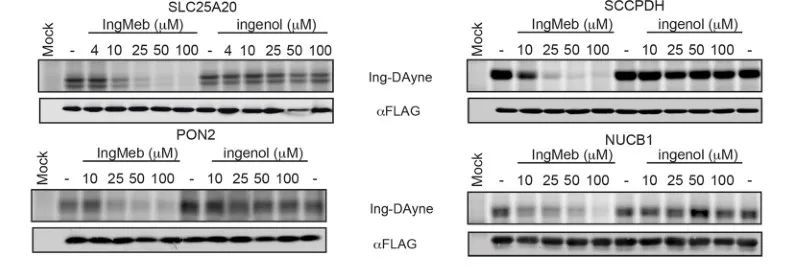
Rycina 5: Eksperymenty Western blot czterech potencjalnych białek docelowych.
4. Ing-Meb reguluje szlak utleniania kwasów tłuszczowych poprzez hamowanie SLC25A20, białka błony mitochondrialnej, znanej również jako alkalilipoilotransferaza botulinowa, ujawniając w ten sposób swój cel jako lek na rogowacenie słoneczne.
Autorzy zbadali SLC25A20, znaną również jako alkaliczna lipoilotransferaza botulinowa lub CACT, multimodalne integralne białko błonowe zlokalizowane w błonie mitochondrialnej. Jej podstawową funkcją jest transport długołańcuchowych acylokarnityn do mitochondriów, ułatwiając ich wymianę z wolną karnityną. Te transportowane acylokarnityny są następnie przekształcane w tłuszczowy acyloCoA przez palmitoilotransferazę karnitynową-2 (CPT-2), służąc w ten sposób jako prekursory β-oksydacji kwasów tłuszczowych. Wyniki eksperymentów wykazały znaczący wzrost zawartości długołańcuchowej acylokarnityny w komórce wraz ze wzrostem stężenia leku Ing-Meb na rogowacenie słoneczne (przedstawione na Figurze 6). Ta obserwacja silnie potwierdza hamujący wpływ Ing-Meb na SLC25A20, potwierdzając w ten sposób SLC25A20 jako jeden z głównych celów pośredniczących w działaniu Ing-Meb.
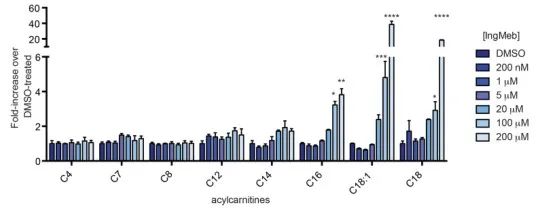
Rysunek 6: Wpływ Ing-Meb na długołańcuchowe acylokarnityny
5. Pośrednia walidacja efektu cytotoksycznego Ing-Meb poprzez ekspresję SLC25A20: ujawnienie jego docelowej funkcji w regulacji aktywności leku.
Badacze starali się bezpośrednio powiązać hamowanie SLC25A20 w komórkach HeLa z potencjalnym działaniem cytotoksycznym Ing-Meb. Wyniki wykazały, że chociaż nadekspresja SLC25A20 nie zmieniła połowy hamującego stężenia Ing-Meb w tych komórkach, warto zauważyć, że zwiększona ekspresja SLC25A20 znacząco złagodziła wpływ Ing-Meb na akumulację długołańcuchowej acylokarnityny (przedstawione na Ryc. 7). . Wynik ten dodatkowo potwierdza hipotezę, że SLC25A20 służy jako kluczowy cel funkcjonalny dla aktywności leku Ing-Meb.
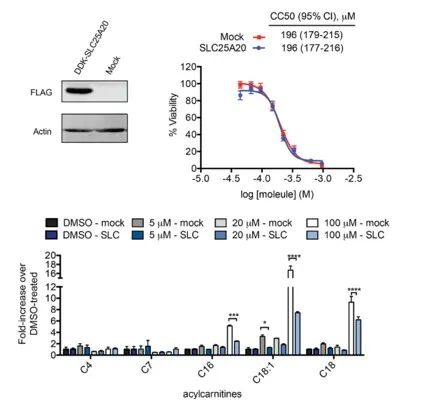
Figura 7: Wpływ ekspresji lub braku SLC25A20 na CC50 i acylokarnitynę.
Badanie to nie tylko ujawnia nowe cele Ing-Meb, ale także zapewnia nową podstawę teoretyczną i kierunek strategiczny dla docelowego odkrywania strukturalnie złożonych produktów naturalnych. Odniesienie:
Odniesienie:https://doi.org/10.1021/acscentsci.7b00420.

