Tło techniczne
Chemiczna technologia proteomiczna jawi się jako latarnia morska zmian, kierująca odkrywanie leków z dala od oczyszczonych białek w kierunku żywych komórek.
Chemiczna technologia proteomiczna stanowi solidną platformę do odkrywania leków, charakteryzującą się badaniem interakcji małych cząsteczek i białek w żywych komórkach. Jedna z naszych platform odkrywania leków kowalencyjnych ma na celu odkrywanie kowalencyjnych środków wiążących, które angażują cele białkowe poprzez reakcje kowalencyjne z grupą tiolową reszt cysteiny. W przeciwieństwie do tradycyjnych strategii przesiewowych ukierunkowanych na jeden cel, platforma proteomiki chemicznej umożliwia ilościową analizę interakcji między fragmentami elektrofilowymi i prawie wszystkimi białkami w żywych komórkach z rozdzielczością reszt aminokwasowych. Obejmuje pokrycie ponad 10 000 białek i~40 000 miejsc cysteinowych (potencjalnych miejsc wiązania leku) z kilku linii komórkowych ssaków.

Przebieg pracy
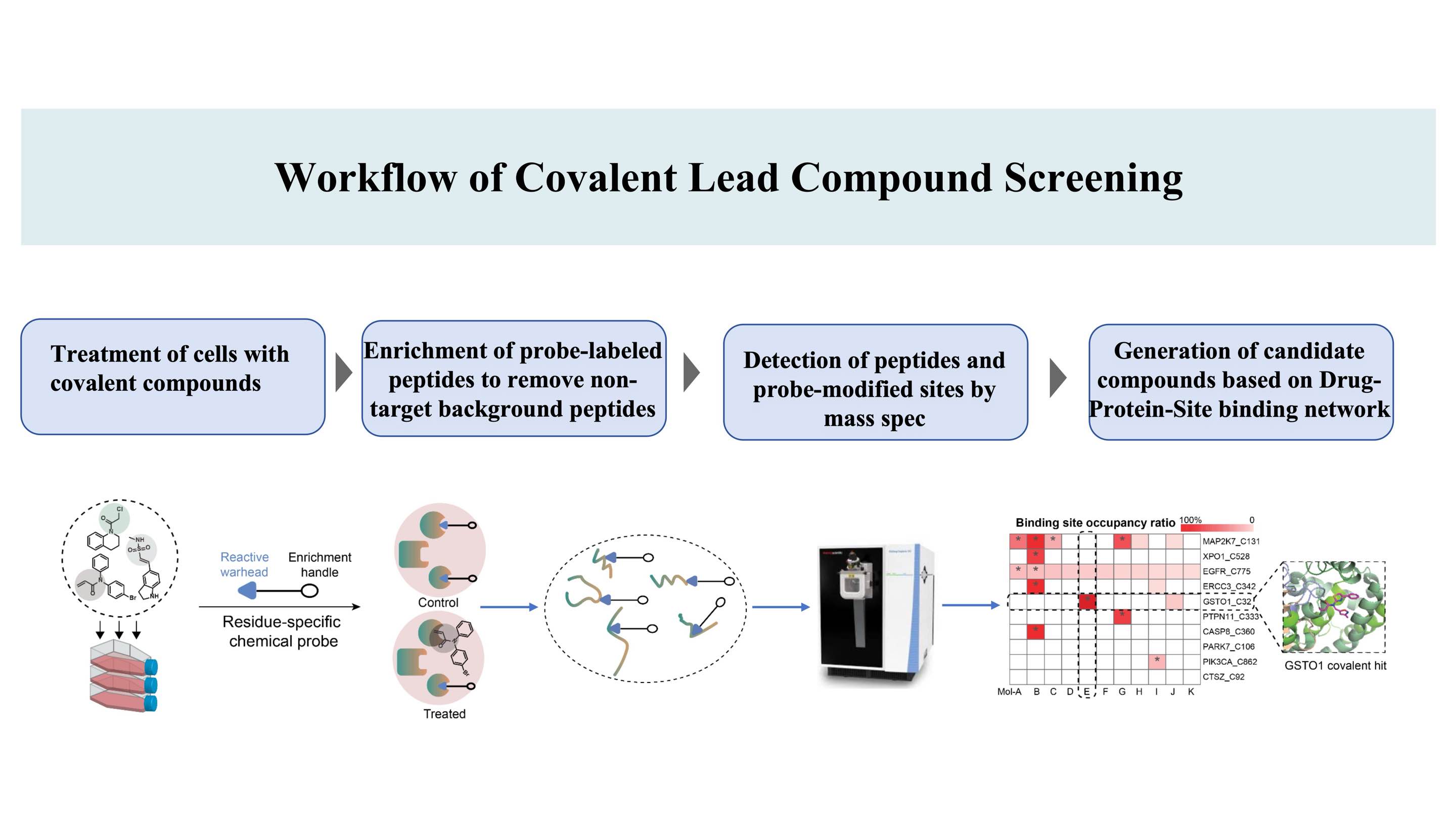
Proces odkrywania związków kowalencyjnych ukierunkowanych na miejsca wiązania* na białkach w oparciu o patent DIA-ABPP (Data-Independent Acquisition-Activity-Based Protein Profiling) (Kowalencyjne miejsce wiązania to aminokwas, który może być znakowany sondami chemicznymi, umożliwiając w ten sposób ligandowalność)
Zalety techniczne
Cecha 1
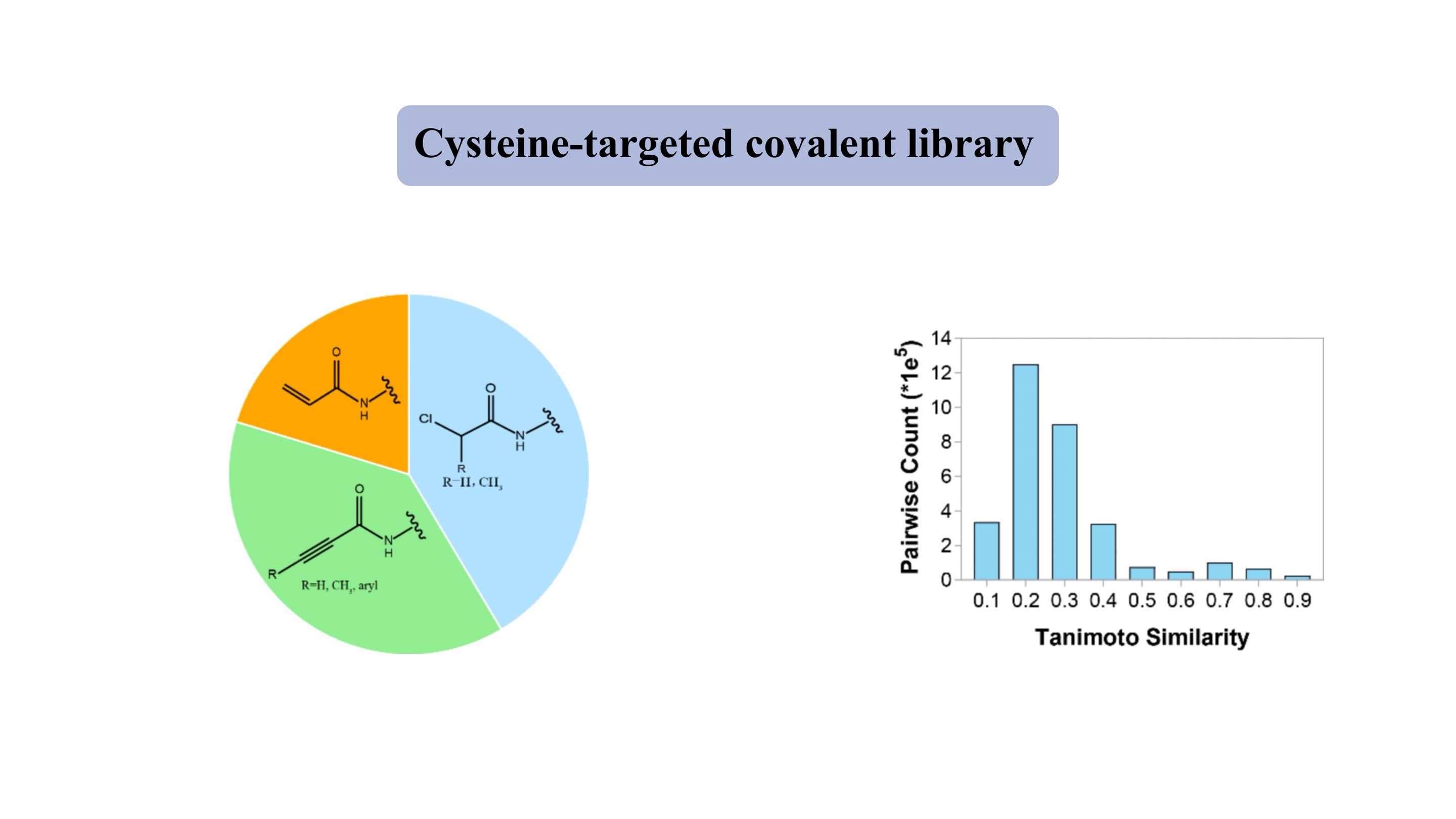
Biblioteka kowalencyjna ukierunkowana na cysteinę
Biblioteka kowalencyjna ukierunkowana na cysteinę zawiera reprezentatywne łagodne elektrofilowe „głowice”, takie jak akryloamidy i chloroacetamidy. Biblioteka „lekowa” zawiera ~ 3000 związków, z czego ponad 80% ma masę cząsteczkową 300-500 Da. W przypadku większości związków wskaźnik podobieństwa Tanimoto wynosi około 0,3 na każde dwa elementy, co wskazuje na wysoki stopień różnorodności.
Cecha 2
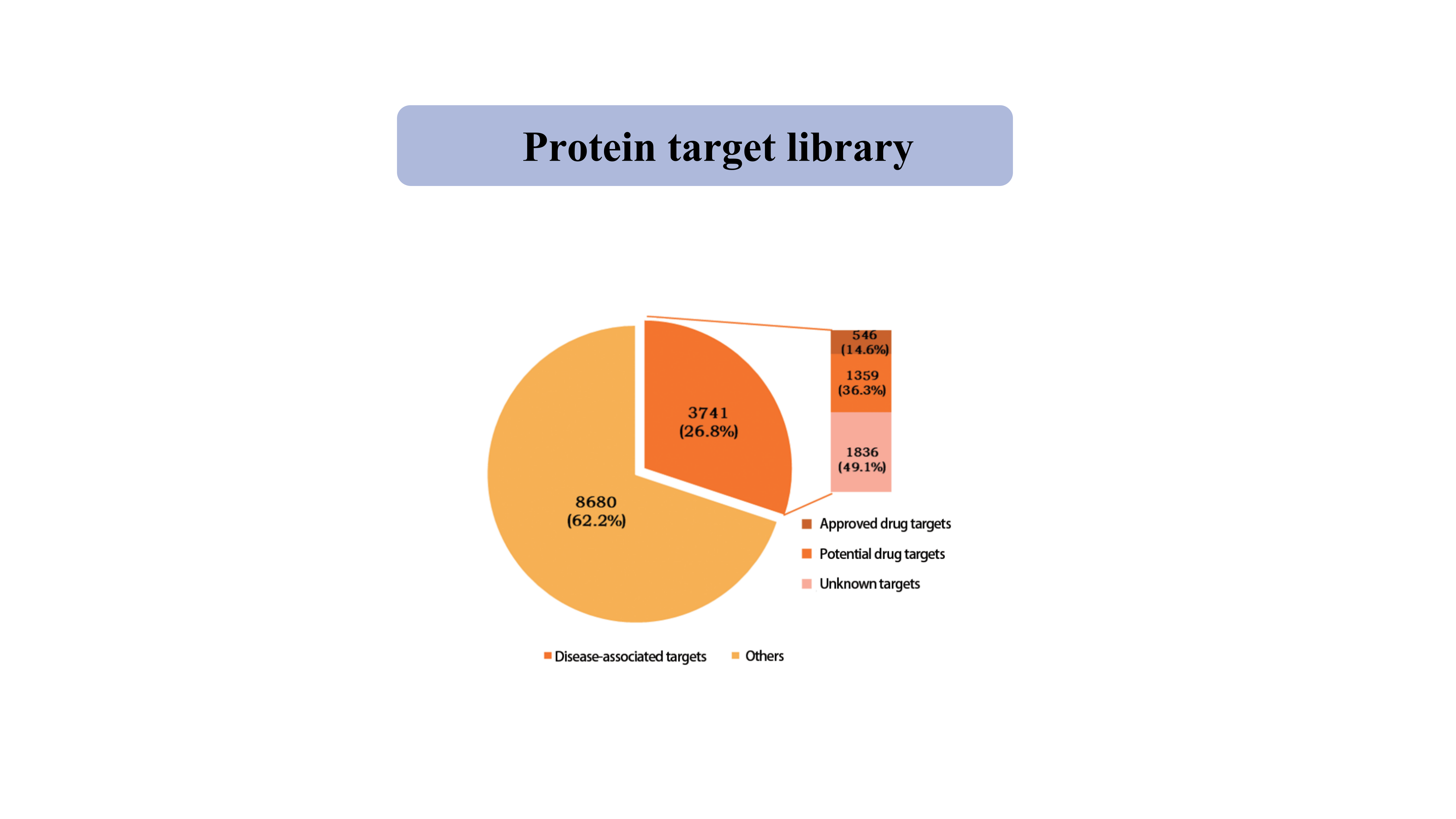
Cel białkowybiblioteka
Obecnie biblioteka celów białkowych wychwytywanych przez sondę chemiczną specyficzną dla tiolu obejmuje 39962 miejsca cysteinowe z 12421 białek, w tym kinazy, fosfatazy, ligazy i czynniki transkrypcyjne.
Studium przypadku
DCAF1 służy jako receptor substratu dla dwóch różnych ligaz E3 (CRL4DCAF1 i EDVP), odgrywając kluczową fizjologiczną rolę w degradacji białek. Opracowano kilka kowalencyjnych i niekowalencyjnych środków wiążących ukierunkowanych na domenę WDR DCAF1 w celu wspierania zastosowań ukierunkowanej degradacji (ukierunkowana degradacja białek przez elektrofilowe PROTAC, które stereoselektywnie i specyficznie angażują DCAF1. J. Am. Chem. Soc. 2022, 144, 40, 18688 –18699. PROTAC oparte na DCAF1 z aktywnością potwierdzoną klinicznie cele przezwyciężania oporu wewnętrznego i nabytego, Commun 2024, 15, 275).
Po raz pierwszy odkryliśmy, że Mol-380 kowalencyjnie współdziała z DCAF1_C69, podkreślając go jako potencjalne miejsce nadające się do stosowania w zastosowaniach TPD, odrębne od domeny WDR. Nasze odkrycia podkreślają znaczącą wartość zautomatyzowanej chemicznej platformy proteomicznej ChomiX w odkrywaniu nowych ligandów dla nieusuwalnych celów w żywych komórkach, w tym czynników transkrypcyjnych i białek błonowych, podkreślając jej potencjalny wpływ na opracowywanie leków i eksplorację funkcjonalną.
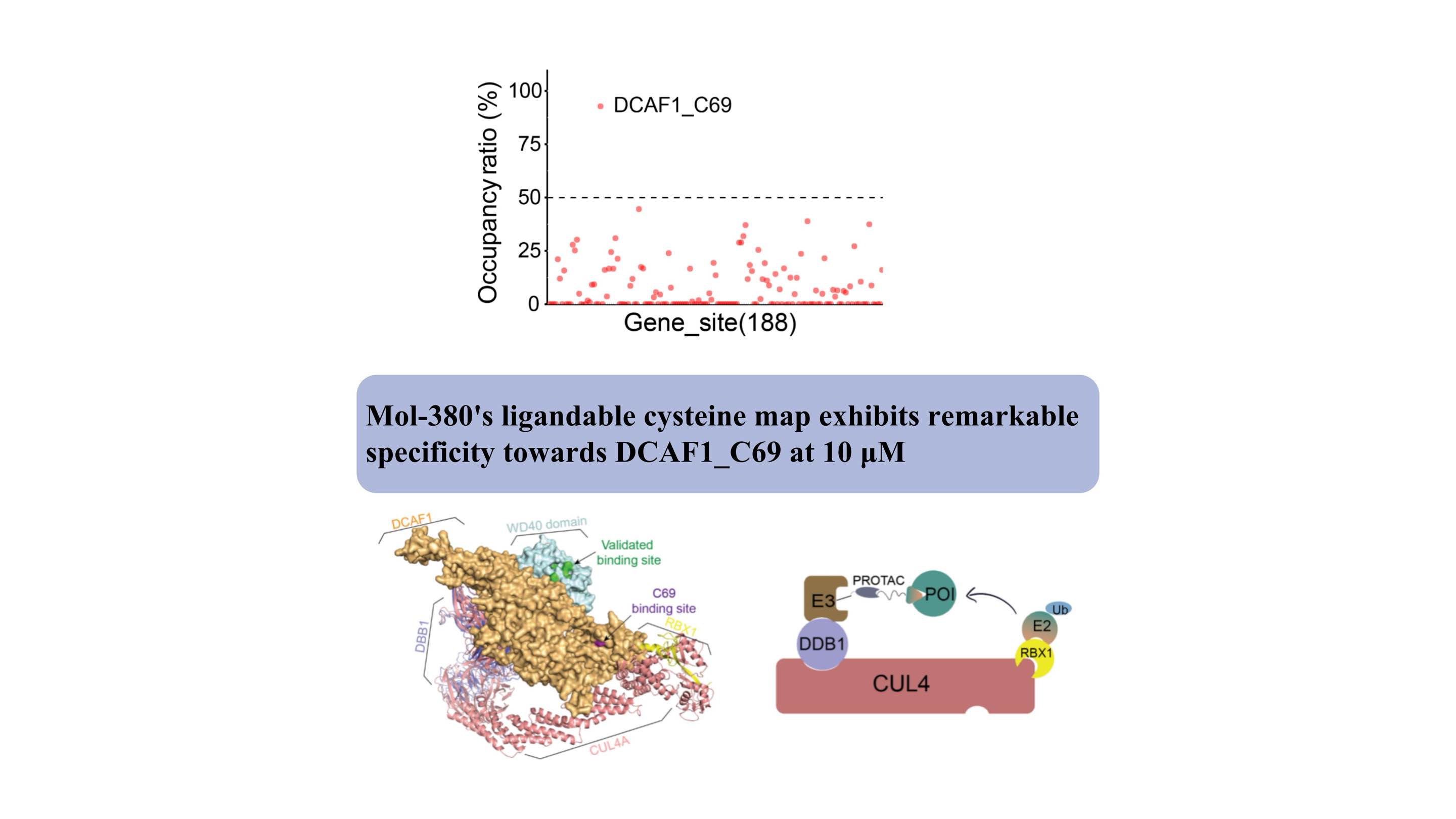
Strukturalnie miejsce wiązania C69 przylega do zatwierdzonej kieszeni w domenie WD40, jak wskazuje złożony model, oferując nowe miejsce dla rozwoju PROTAC.

