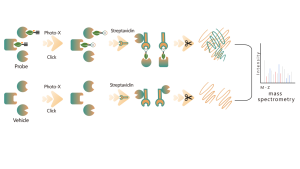Produkty
Analiza omikowa modyfikacji potranslacyjnych cysteiny
Cysteina, ze swoją niezwykłą reaktywnością, odgrywa kluczową rolę w strukturze i funkcjonowaniu białek. Służąc jako odczynnik nukleofilowy, centrum katalityczne redoks, ligand jonów metalu i kluczowe miejsce zmian konformacyjnych, szeroko uczestniczy w aktywności białek i mechanizmach regulacyjnych i wywiera na nie głęboki wpływ. Warto zauważyć, że reszty cysteiny są podatne na różnego rodzaju modyfikacje potranslacyjne (PTM), które nie tylko precyzyjnie dostosowują właściwości funkcjonalne białek, ale mogą również prowadzić do upośledzenia funkcjonalnego. Biorąc pod uwagę ścisły związek takich modyfikacji z wieloma poważnymi chorobami człowieka, analiza jakościowa i ilościowa cysteinowych PTM w białkach ma ogromne znaczenie. Ma to niezastąpioną wartość dla dogłębnego zrozumienia funkcji biologicznych odpowiednich białek i mechanizmów ich działania w stanach zdrowia i chorobie.
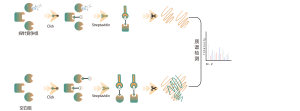
Chomix ma bogate doświadczenie w identyfikacji modyfikacji cysteiny, takich jak persiarczdacja cysteiny. Innowacyjne wykorzystanie uniwersalnych sond cysteinowych w oparciu o różnicę w pKa między -SH i -SSH, regulujemy pH, aby zmniejszyć zakłócenia tła ze strony -SH, umożliwiając sondom głównie znakowanie -SSH, a tym samym skuteczną identyfikację miejsc sulfenylacji.
Chomix posiada zaawansowaną technologię spektrometrii mas, zdolną do bezpośredniego i dokładnego rozróżniania różnych typów modyfikacji potranslacyjnych białek i ich specyficznych miejsc. Dzięki sprytnej integracji technik separacji i wzbogacania ze znakowaniem izotopowym i innymi zaawansowanymi metodami, umożliwiamy wielkoskalową, wysokowydajną analizę jakościową i ilościową różnych modyfikacji, zapewniając solidne wsparcie techniczne dla dogłębnych badań nad modyfikacjami potranslacyjnymi białek.

Nasze zalety
1. Profesjonalna wiedza: Dzięki bogatemu doświadczeniu i publikacjom w wiodących czasopismach oferujemy usługi dostosowane do indywidualnych potrzeb w celu uzyskania optymalnych wyników.
2. Rygorystyczne zarządzanie jakością: Nasze dojrzałe systemy jakości są zgodne z normami ISO9001, zapewniając wiarygodne raporty.
3. Kompleksowa obsługa: od projektu sondy po analizę bioinformatyczną – zapewniamy kompleksowe konsultacje po dostawę, wraz z aktualnymi aktualizacjami postępów.
4. Zaawansowany sprzęt: Wyposażony w najnowocześniejsze spektrometry mas, takie jak Thermo Fisher Orbitrap Exploris 480 i Bruker timsTOF, wspieramy przełomowe badania.
Nasz serwis
| Projekt | Analiza omikowa modyfikacji potranslacyjnych cysteiny |
| Próbka | Czyste białko, lizat komórkowy, żywe komórki, chora tkanka, krew, bakterie, tkanka roślinna |
| Platforma sprzętowa | Bezkontaktowy ultradźwiękowy rozdrabniacz komorowy, system obrazowania ChemiDoc MP, spektrometr mas Orbitrap Fusion Lumos Tribrid/Orbitrap Exploris 480/Q Exactive HF-X/timsTOF Pro 2 |
| Czas trwania projektu | 4-8 tygodni |
| Elementy dostarczane | Raport z projektu (w tym procedury eksperymentalne, wykresy analizy danych, wyniki analiz bioinformatycznych) |
| Cena | Kliknij, aby skonsultować się |
Studium przypadku
Tiolowanie odnosi się do sprzęgania grupy tiolowej (-SSH) z resztami cysteiny w białkach, za pośrednictwem siarkowodoru (H2S). Aby dokładniej zbadać ten proces, z próbek komórek lub tkanek można ekstrahować całe proteomy i znakować je za pomocą sondy chemicznej (sonda specyficzna dla cysteiny). W odróżnieniu od interferencji tiolowej, metoda ta umożliwia efektywne znakowanie grup tiolowych poprzez precyzyjne ustawienie pH. Następnie, za pomocą wysokorozdzielczej spektrometrii mas, badacze mogą dokładnie zidentyfikować miejsca tiolowania, tym samym dokładniej wyjaśniając ważną rolę tej modyfikacji potranslacyjnej in vivo.
Korzystając z modeli komórek HeLa, najpierw wyekstrahowano cały proteom. Następnie modelowanie za pomocą NaHS i regulacji pH pozwoliło na dokładne oznaczenie grup tiolowych za pomocą uniwersalnej sondy cysteinowej. W wyniku serii etapów obejmujących wzbogacanie, trawienie enzymatyczne i wykrywanie za pomocą spektrometrii masowej zidentyfikowano 180 peptydów zawierających modyfikacje -SSH wraz ze 120 białkami pokrewnymi, w tym zgłoszonymi miejscami tiolacji GAPDH_C152 i C247.

Oto widma MS/MS peptydów z modyfikacjami -SSH: