
Produkty
Nowe perspektywy terapeutyczne dla medycyny tradycyjnej: Technologia ABPP odkrywa nowatorski cel przeciwzapalny berberyny EIF2AK2
Tradycyjna medycyna jest ożywiana dzięki nowym zastosowaniom farmakologicznym, ponieważ zaawansowane techniki, takie jak profilowanie białek w oparciu o aktywność (ABPP), rzucają światło na nieznane wcześniej mechanizmy terapeutyczne. W tym kontekście technologia ABPP ujawniła niedawno nowy cel przeciwzapalny, jakim jest berberyna, związek ekstrahowany z tradycyjnych chińskich roślin leczniczych, powszechnie znany w Chinach jako koptyzyna lub huanglian. Odkrycie podkreśla, że EIF2AK2 odgrywa kluczową rolę w działaniu przeciwzapalnym berberyny, otwierając nowe możliwości jej zastosowania w leczeniu chorób związanych ze stanem zapalnym. To przełomowe odkrycie podkreśla potencjał zmiany przeznaczenia i optymalizacji tradycyjnych leków za pomocą nowoczesnych metod naukowych.

Dużą uwagę przykuwa berberyna, tradycyjny alkaloid o szerokim działaniu farmakologicznym, w tym przeciwzapalnym, hipoglikemicznym i chroniącym układ sercowo-naczyniowy. Jednak jego dokładne mechanizmy molekularne, szczególnie w tłumieniu stanu zapalnego, pozostają niejasne.
Niniejsze badanie wypełnia tę lukę w wiedzy, wykorzystując technologię ABPP do zidentyfikowania EIF2AK2 jako krytycznego celu zaangażowanego przez berberynę w jej działaniu przeciwzapalnym. Odkrycia pogłębiają naszą wiedzę na temat mechanizmu działania berberyny i dostarczają naukowych podstaw do zmiany położenia berberyny i opracowania nowych leków przeciwzapalnych ukierunkowanych na EIF2AK2.
Zespół zastosował zaawansowane metody chemoproteomiczne do systematycznego badania interakcji berberyny z białkami wewnątrzkomórkowymi, potwierdzając jej specyficzne wiązanie z EIF2AK2 i modulację jej aktywności enzymatycznej. Wpływa to na szlaki odpowiedzi zapalnej, skutecznie hamując postęp stanu zapalnego. Ten znaczący przełom zapewnia wgląd w mechanizm przeciwzapalny berberyny i wspiera rozwój nowych terapii ukierunkowanych na EIF2AK2.
ChomiX świadczy najnowocześniejsze usługi, takie jak ABPP i CETSA, aby pomóc badaczom w badaniu mechanizmów działania leków i przyspieszaniu prac nad nowymi lekami.
Trasa Badawcza
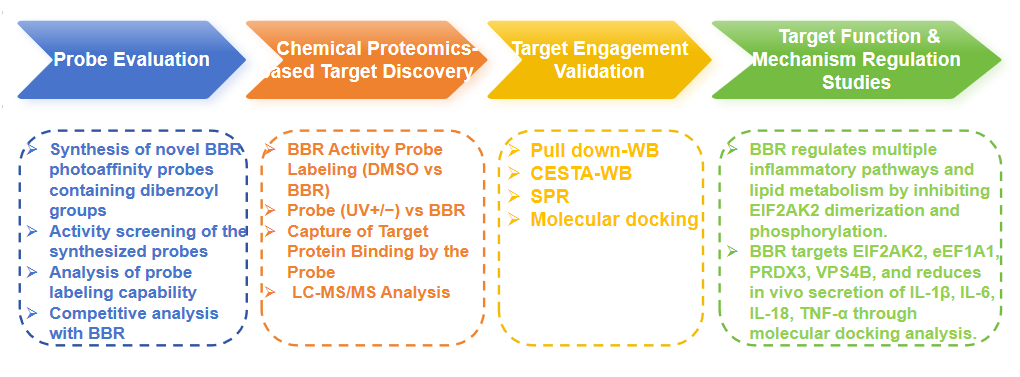
Proces eksperymentalny
1. Sonda 11b została wykorzystana jako narzędzie funkcjonalne w badaniach proteomicznych.
Autorzy zsyntetyzowali i przeszukali nowe sondy fotopowinowactwa BBR zawierające grupy dibenzoilowe w makrofagach THP-1 aktywowanych LPS + nigerycyną. Wśród nich związki 7a i 11b wykazywały zależne od czasu i dawki działanie hamujące na ekspresję IL-1β, wykazując zwiększoną skuteczność w porównaniu ze związkiem macierzystym BBR. Dzięki analizie profilowania białek opartego na aktywności (ABPP) i skanowaniu fluorescencyjnemu udowodniono, że zarówno 7a, jak i 11b skutecznie wiążą się z białkami docelowymi i wykazują hamowanie konkurencyjne, wskazując w ten sposób mechanizm działania podobny do BBR. Na podstawie obserwacji, że związek 11b wykazywał wyraźne zmiany w intensywności fluorescencji w zakresie stężeń od 2,5% do 25%, szczególnie w stężeniu 20 milimoli, gdzie zmienność sygnału fluorescencji była najbardziej widoczna, wybrano go jako funkcjonalną sondę do badań proteomicznych . Wybór ten opierał się na jego doskonałej responsywności, co czyni go odpowiednim do wyjaśniania interakcji białek w warunkach proteomicznych.
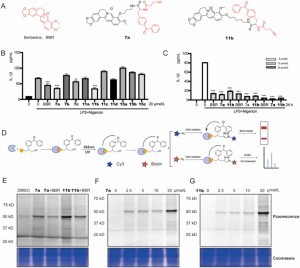
Rysunek 1: Przegląd i ocena sond BBR.
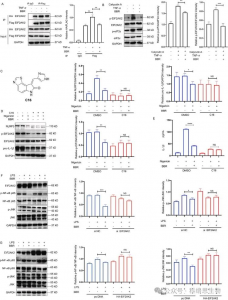
2. Nowatorska sonda 11b zidentyfikowała 44 białka docelowe BBR związane ze stanem zapalnym w komórkach THP-1 i ujawniła, że EIF2AK2, eEF1A1, PRDX3 i VPS4B są bezpośrednimi celami ze specyficznymi interakcjami z BBR.
Autorzy, w drodze serii eksperymentów, z powodzeniem zastosowali nową sondę 11b do znakowania i oczyszczania potencjalnych białek docelowych w komórkach THP-1. Następnie wykorzystali analizę LC-MS/MS do zidentyfikowania 44 białek związanych ze stanem zapalnym w zakresie masy cząsteczkowej od 20 do 80 kDa, spośród których sześć potencjalnie odgrywało kluczową rolę w działaniu przeciwzapalnym BBR. W dalszych badaniach potwierdzono, że EIF2AK2, eEF1A1, PRDX3 i VPS4B są bezpośrednimi celami BBR, wykazując konkurencyjne działanie hamujące przy wysokich stężeniach leczenia BBR. Odkrycie to ujawniło prawdopodobne istnienie specyficznych interakcji pomiędzy tymi białkami i BBR, wyjaśniając w ten sposób nowe spostrzeżenia na temat ich zaangażowania w lek podczas jego procesów przeciwzapalnych.
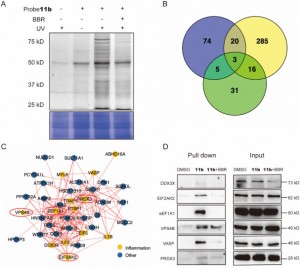
Rysunek 2: Wychwytywanie białek docelowych i analiza funkcjonalna.
3. Badania z zakresu biologii strukturalnej wyjaśniają, w jaki sposób BBR moduluje dimeryzację EIF2AK2, aby wywierać działanie przeciwzapalne poprzez krytyczne interakcje jonowe i wiązanie kation-pi.
Autorzy zastosowali techniki CETSA, SPR i dokowanie molekularne, aby zweryfikować interakcje między BBR i czterema białkami – EIF2AK2, eEF1A1, PRDX3 i VPS4B – w komórkach HEK-293. Wyniki pokazały, że BBR zwiększył stabilność termiczną tych czterech białek, przy czym największe powinowactwo zaobserwowano w przypadku EIF2AK2. Dalsze badania wykazały, że wiązanie BBR z EIF2AK2 opiera się głównie na parach jonowych obejmujących D316 i E367 we wnęce II, a także na interakcjach kation-pi z K291. To miejsce wiązania bierze udział w dimeryzacji EIF2AK2, co sugeruje, że BBR może wywierać działanie przeciwzapalne poprzez modulowanie dimeryzacji EIF2AK2.
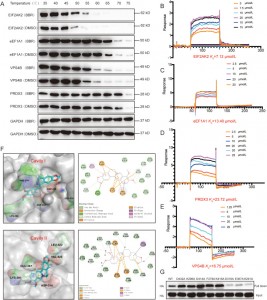
Rysunek 3: Badania powinowactwa pomiędzy BBR i jego potencjalnymi celami.
4. Ujawniono rolę BBR w procesach zapalnych i metabolizmie lipidów, ponieważ hamuje on dimeryzację i fosforylację EIF2AK2, wykazując w ten sposób kluczową funkcję w regulacji sygnalizacji inflamasomu NLRP3, NF-kB p65/JNK/SIRT1.
Eksperymenty immunoprecypitacyjne potwierdziły, że BBR hamuje dimeryzację EIF2AK2, wpływając zarówno na autofosforylację EIF2AK2, jak i fosforylację jego substratu eIF2a, ujawniając w ten sposób, że BBR reguluje inflamasom NLRP3, NF-kB p65, szlaki sygnałowe JNK i ekspresję SIRT1, odgrywając kluczową rolę w komórkowych odpowiedziach zapalnych, mózgowe mechanizmy przeciwzapalne (takie jak w chorobie Alzheimera) i tłuszczowe wywołany kwasem stres siateczki śródplazmatycznej. Dodatkowo wyciszenie lub nadekspresja EIF2AK2 znacząco zmieniło wpływ regulacyjny BBR na p-JNK i SIRT1, co dodatkowo potwierdza, że BBR działa poprzez wiązanie z EIF2AK2 w celu regulacji zaburzeń metabolizmu lipidów związanych ze stanem zapalnym.
Rycina 2 Wychwytywanie białek docelowych i analiza funkcjonalna.
5. Celując w EIF2AK2, eEF1A1, PRDX3 i VPS4B, BBR reguluje wiele szlaków zapalnych, przy czym EIF2AK2 odgrywa dominującą rolę regulacyjną wśród tych celów.
Aby dokładniej zbadać tę interakcję, autorzy stworzyli modele nadekspresji i knockdown czterech białek, wykazując, że BBR selektywnie moduluje szlaki zapalne JNK, NF-kB, MAPK i AKT, przy czym EIF2AK2 odgrywa dominującą rolę, co potwierdzono w eksperymentach in vivo .
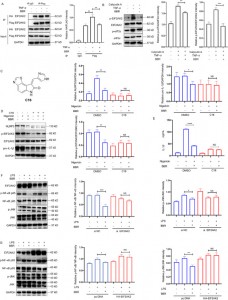
Rycina 5: Badania funkcjonalne białek docelowych BBR
6. Poprzez specyficzne ukierunkowanie na EIF2AK2, BBR reguluje w dół wydzielanie in vivo IL-1β, IL-6, IL-18 i TNF-α; wyłączenie genu EIF2AK2 zmniejsza jego skuteczność przeciwzapalną i działanie ochronne na wątrobę.
Następnie zbadali, czy BBR wpływa na uwalnianie IL-1β, IL-6, IL-18 i TNF-α, celując w EIF2AK2 in vivo. W tym celu stworzyli mysi model z nokautem genu EIF2AK2, stosując dożylne wstrzyknięcie wirusa związanego z adenowirusem (AAV) przenoszącego shEIF2AK2. Myszom typu dzikiego i z nokautem EIF2AK2 podano dootrzewnowo BBR (3 mg/kg), a następnie wstrzyknięto LPS. Podczas gdy BBR znacząco obniżył poziomy IL-1β, IL-6, IL-18 i TNF-α w grupie kontrolnej, efekt ten został osłabiony w grupie z nokautem EIF2AK2. Badanie histologiczne poprzez barwienie tkanki wątroby H&E wykazało, że łagodzący wpływ BBR na nacieki zapalenia wątroby był osłabiony u myszy z nokautem EIF2AK2. Odkrycia te sugerują, że BBR potencjalnie zmniejsza wydzielanie IL-1β, IL-6, IL-18 i TNF-α poprzez celowanie w EIF2AK2 i wykazuje dobre bezpieczeństwo.
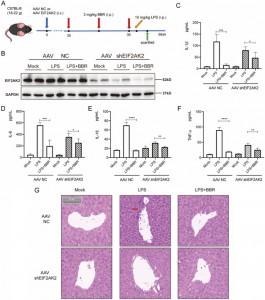
Rysunek 6: Weryfikacje funkcjonalne EIF2AK2 in vivo.
Badanie to w pełni demonstruje potężne zalety technologii ABPP w wyjaśnianiu złożonych mechanizmów cząsteczek bioaktywnych, takich jak berberyna, napędzając postęp nowoczesnych badań nad tradycyjnymi lekami. Odkrywając nowe cele i mechanizmy działania starej berberyny, leku, nie tylko wzbogaca naszą wiedzę na temat biologicznych funkcji tradycyjnych leków, ale także otwiera nowe perspektywy i możliwości leczenia chorób związanych ze stanami zapalnymi. Wynik ten zapowiada, że przy wsparciu nowoczesnych technik naukowych, takich jak ABPP, bardziej tradycyjne leki zostaną ponownie wykorzystane poprzez identyfikację ich konkretnych celów i mechanizmów, wnosząc znaczący wkład w wysiłki na rzecz zdrowia ludzkiego.
Odniesienie:https://doi.org/10.1016/j.apsb.2022.12.009.
