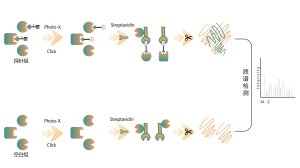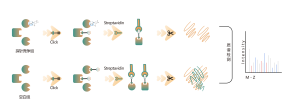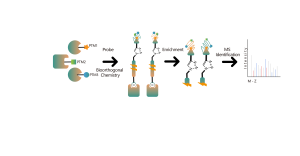Produkty
Interakcje małych cząsteczek i białek
Białka, jako bezpośredni uczestnicy i wykonawcy czynności życiowych, stanowią kluczowe cele terapii chorób. Leki małocząsteczkowe (związki organiczne, zazwyczaj o masie cząsteczkowej mniejszej niż 1000 Da) wywierają skuteczne działanie terapeutyczne poprzez precyzyjną modulację aktywności białek, ich liczebności i interakcji. Powszechnie stosowane leki małocząsteczkowe obejmują produkty naturalne i ich pochodne (np. monomery ziołowe), a także leki syntetyzowane chemicznie. Po dostaniu się do organizmu człowieka leki te wywierają działanie terapeutyczne poprzez wiązanie się z docelowymi białkami w komórkach lub na zewnątrz. Dlatego zrozumienie, w jaki sposób leki małocząsteczkowe wiążą się z białkami docelowymi, jest szczególnie istotne w opracowywaniu leków, zwłaszcza w złożonych środowiskach fizjologicznych, takich jak żywe komórki, krew i chore tkanki. Dogłębna analiza interakcji między lekami małocząsteczkowymi a białkami nie tylko umożliwia precyzyjną identyfikację celów leku, ale także ujawnia molekularne mechanizmy działania leku i potencjalne skutki odbiegające od celu. Co więcej, daje nadzieję na odkrycie nowych celów terapeutycznych, zapewniając w ten sposób bogatsze strategie leczenia chorób.
Oprócz leków drobnocząsteczkowych endogenne metabolity drobnocząsteczkowe w organizmach, takie jak ATP, cholesterol, kwasy żółciowe, kwas arachidonowy i kwas retinowy, uczestniczą w regulacji wielu ważnych szlaków sygnałowych i aktywności białek poprzez interakcję z białkami, w tym białkami transportowymi, błoną receptory, czynniki transkrypcyjne i enzymy metaboliczne. W ostatnich latach interakcja między metabolitami mikroflory jelitowej a komórkami gospodarza stała się gorącym punktem badawczym. Dlatego dokładne badanie i mapowanie sieci interakcji pomiędzy metabolitami i białkami w środowiskach komórkowych, zwłaszcza w stanach chorobowych, ma istotne znaczenie dla zrozumienia procesów życiowych i leczenia chorób.
Proteomika chemiczna, jako znacząca gałąź biologii chemicznej, jest obecnie szeroko stosowana w badaniach funkcji białek, identyfikacji docelowych leków małocząsteczkowych i badaniu przesiewowym nowej struktury leków. Ta platforma technologiczna wykorzystuje różnorodne funkcjonalnie zróżnicowane sondy chemiczne w połączeniu z proteomiką, a jej celem jest wyjaśnienie mechanizmów interakcji między małymi cząsteczkami i białkami w warunkach fizjologicznych (takich jak żywe komórki, krew, tkanki itp.). Warto wspomnieć, że w porównaniu z systemami oczyszczonych białek, wykorzystanie systemów żywych komórek jest główną cechą proteomiki chemicznej. Pozwala na realistyczne zobrazowanie rozmieszczenia celów dla leków małocząsteczkowych, endogennych metabolitów itp. w obrębie złożonych proteomów, nawet do poziomu miejsc reszt aminokwasowych.
Chomix oferuje profesjonalne usługi analizy interakcji małych cząsteczek z białkami, umożliwiając głębsze wnikanie w potencjalne cele leku i lepsze zrozumienie mechanizmów molekularnych leków i potencjalnych skutków ubocznych. Nasz zespół ekspertów posiada szerokie doświadczenie w badaniach proteomiki chemicznej i wybierze dla Ciebie najbardziej odpowiednie i niezawodne metody, eliminując wszelkie obawy związane z wyzwaniami technicznymi i ułatwiając postęp Twoich badań bez wysiłku.

Serwis Techniczny
1. Identyfikacja bezpośrednich celów dla niekowalencyjnych leków drobnocząsteczkowych
Większość leków małocząsteczkowych oddziałuje z białkami docelowymi poprzez wiązanie niekowalencyjne, tworząc dynamiczne i odwracalne interakcje z resztami aminokwasowymi w kieszeniach wiążących poprzez wiązania wodorowe, układanie π-π, interakcje hydrofobowe itp. Dlatego stabilne wzbogacanie i izolacja białek związanych niekowalencyjne leki małocząsteczkowe ze złożonych proteomów stwarzają poważne wyzwania. Aby rozwiązać ten problem, w ramach projektu Chomix opracowano platformę identyfikacji celów z zakresu proteomiki chemicznej, opartą na fotosondach. Platforma ta dokładnie rejestruje dynamiczne wiązanie między małymi cząsteczkami i białkami w żywych komórkach oraz zapewnia separację i wzbogacenie, kompleksowo identyfikując w ten sposób bezpośrednie cele dla niekowalencyjnych leków małocząsteczkowych na poziomie proteomicznym.
2. Identyfikacja kieszeni wiążących dla niekowalencyjnych leków drobnocząsteczkowych
W procesie opracowywania leku małocząsteczkowego kluczowe jest najpierw określenie informacji o wiązaniu leku z białkiem, a następnie określenie, z którą konkretną kieszenią na powierzchni białka wiąże się lek i w jaki sposób. Informacje te są niezbędne do późniejszej optymalizacji struktury leku. Oprócz klasycznych podejść do biologii strukturalnej, w ramach projektu Chomix opracowano także zaawansowaną platformę technologiczną proteomiki chemicznej opartą na wysokiej rozdzielczości spektrometrii mas. Platforma ta może identyfikować peptydy wiążące niekowalencyjne leki małocząsteczkowe na poziomie białka, a nawet na poziomie komórkowym, pomagając w ten sposób w rozwiązaniu tego krytycznego problemu na wczesnym etapie opracowywania leków.
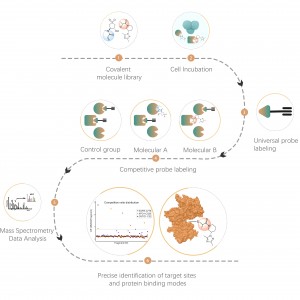
3. Ilościowa analiza zajętości i selektywności kowalencyjnych celów leków drobnocząsteczkowych
Leki kowalencyjne odnoszą się do leków, które tworzą stabilne wiązania kowalencyjne z resztami aminokwasów w kieszeniach wiążących na białkach docelowych, takich jak te wiążące się z cysteiną, lizyną, seryną itp. Powszechnie stosowane leki kowalencyjne obejmują aspirynę, ozymertynib, zebularynę, a także produkty naturalne, takie jak artemizynina i artesunat. W żywych komórkach leki kowalencyjne mogą stabilnie wiązać się i zajmować określone reszty aminokwasowe na białkach docelowych. Wykorzystując tę cechę, Chomix z sukcesem opracował platformę proteomiki chemicznej opartą na uniwersalnej sondzie. Platforma ta umożliwia ilościową analizę zajętości miejsca docelowego dla kowalencyjnych leków małocząsteczkowych, aż do poziomu reszt aminokwasowych. Co więcej, analizując informacje o zajęciu ponad 10 000 miejsc reszt aminokwasowych, można określić selektywność docelową przy różnych stężeniach leku, zapewniając przydatne wskazówki dotyczące wczesnego opracowywania leków.
4. Identyfikacja i analiza selektywności docelowych substancji degradujących białka
Jako nowy rodzaj leku, chimery ukierunkowane na proteolizę (PROTAC) różnią się od tradycyjnych małocząsteczkowych inhibitorów lub aktywatorów. Podważają konwencjonalną koncepcję rozwoju „opartego na obłożeniu” w chemii medycznej, wykorzystując endogenny układ ubikwityna-proteasom (UPS) do specyficznej degradacji białek chorobotwórczych, zwłaszcza tych uważanych za cele „niepoddające się leczeniu”. Dlatego ilościowa identyfikacja celów leków degradujących białka i ich selektywność na poziomie całego proteomu ma kluczowe znaczenie dla wczesnego rozwoju takich leków. Chomix z powodzeniem opracował różne ilościowe platformy technologii chemicznej proteomiki, umożliwiające jakościową i ilościową analizę ponad 5000 białek w poszczególnych liniach komórkowych, zapewniając wszechstronną i dogłębną analizę selektywności docelowej.