Odkrywanie tajemnicy małej cząsteczki WA: Rzucanie światła na regulację enzymu PHGDH i torowanie drogi nowatorskim terapiom przeciwnowotworowym
Seryna, niezbędny aminokwas, spełnia różne istotne funkcje biologiczne w organizmach żywych. Służy nie tylko jako podstawowy składnik w syntezie białek, ale także uczestniczy w regulacji wielu szlaków metabolicznych, w tym w syntezie nukleotydów, metabolizmie metioniny i funkcjach przeciwutleniających. Wśród tych szlaków kluczowe znaczenie ma dehydrogenaza fosfopirogronianowa (PHGDH), ponieważ katalizuje początkowy etap szlaku syntezy seryny, przekształcając 3-fosfoglicerynian w 3-fosfohydroksypirogronian. Biorąc pod uwagę jego kluczową rolę w metabolizmie seryny, wszelkie zaburzenia w funkcjonowaniu PHGDH są ściśle powiązane z pojawieniem się i postępem wielu chorób, zwłaszcza raka.
W artykule przedstawiono innowacyjne podejście, które wykorzystuje proteomię chemiczną i techniki analizy fenotypowej w celu zidentyfikowania związku zdolnego do kowalencyjnego hamowania PHGDH. Chociaż większość inhibitorów PHGDH ma zazwyczaj charakter konkurencyjny, autorzy przedstawiają Withangulatynę A (WA), naturalną małą cząsteczkę, jako nowy kowalencyjny inhibitor PHGDH. WA okazuje się obiecującym związkiem wiodącym w opracowywaniu inhibitorów PHGDH. Ponadto WA służy jako cenna sonda do badania funkcjonalności PHGDH i szlaku syntezy seryny (SSP). Wykorzystując ten inhibitor, badacze uzyskują głębszy wgląd w mechanizmy regulacyjne regulujące metabolizm seryny, otwierając w ten sposób możliwości badania potencjalnych metod leczenia powiązanych chorób, zwłaszcza raka.
Odkrycie to nie tylko oferuje obiecujące kierunki rozwoju nowych strategii leczenia farmakologicznego, ale także dostarcza kluczowych informacji na temat roli metabolizmu seryny w postępie choroby.
Trasa Badawcza
Proces eksperymentalny
1. Porównanie WP i WA w doświadczeniach cytotoksyczności.
W badaniu autor opracował i zsyntetyzował złożoną sondę nazwaną WP. Wykorzystując ludzkie komórki raka okrężnicy (HCT-116) i normalne komórki okrężnicy (NCM460), autorzy zaobserwowali, że WP wykazywał cytotoksyczność porównywalną do WA. Sugeruje to, że włączenie markerów alkinowych nie zmieniło znacząco jego działania cytotoksycznego. Co więcej, autorzy zauważyli, że WA wykazywał niższą cytotoksyczność w normalnych komórkach okrężnicy, ale wyższą cytotoksyczność w komórkach raka okrężnicy, co podkreśla jego zwiększoną selektywność wobec komórek raka okrężnicy.
Następnie autorzy zastosowali strategię profilowania białek w oparciu o aktywność (ABPP), wykorzystując sondę WP w komórkach HCT-116. Podejście to doprowadziło do identyfikacji PHGDH jako bezpośredniego białka docelowego WA. Walidację eksperymentalną przeprowadzono przy użyciu testów WB-pull down, co potwierdziło ustalenia.
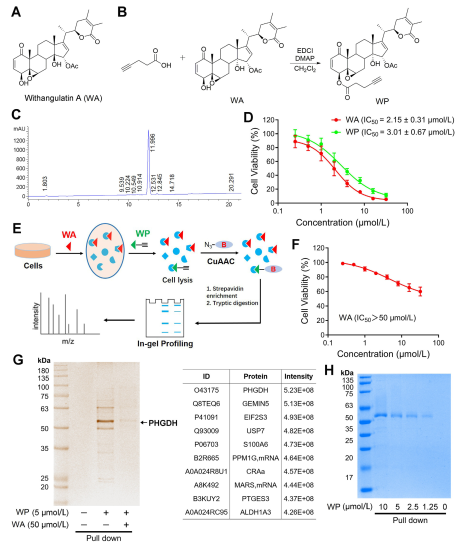
Rycina 1: Chemiczne podejście proteomiczne do identyfikacji celów Withangulatyny A.
2. Potwierdzenie bezpośredniej interakcji pomiędzy WA i PHGDH.
Wykorzystując technologię profilowania białek w oparciu o aktywność (ABPP), autorzy zidentyfikowali PHGDH jako bezpośredni cel związku WA w komórkach HCT-116. Aby zweryfikować interakcję między WA i PHGDH, autorzy przeprowadzili eksperymenty ze stabilnością celu reagującą na powinowactwo leku (DARTS) i testem komórkowego przesunięcia termicznego (CETSA). Wyniki wykazały, że WA zwiększa stabilność termiczną PHGDH i znacząco hamuje jego aktywność. Ponadto eksperymenty interferometrii biowarstwowej (BLI) dostarczyły dalszego potwierdzenia bezpośredniej interakcji między WA i PHGDH.
Autorzy zbadali także nieodwracalny charakter wiązania WA z PHGDH. Ich eksperymenty wykazały, że PHGDH zapobiega wiązaniu WP; jednakże wstępna inkubacja z roztworami zawierającymi N-acetylocysteinę (NAC) lub glutation (GSH) może odwrócić wiązanie WP z PHGDH. Odkrycia te sugerują nieodwracalne kowalencyjne wiązanie pomiędzy WA i resztami cysteiny w białku PHGDH.
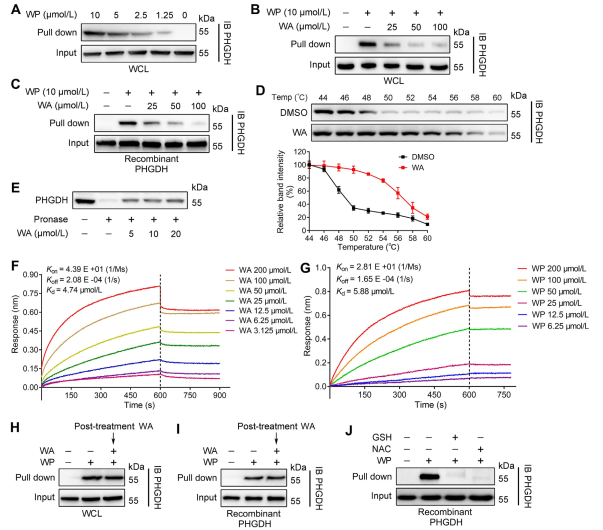
Rysunek 2: WA bezpośrednio wiąże się z PHGDH.
3. WA kowalencyjnie wiąże się z PHGDH poprzez α-β-nienasycone ugrupowanie ketonowe.
Aby dokładniej wyjaśnić mechanizm interakcji WA z PHGDH, badacze przeprowadzili eksperymenty w celu potwierdzenia kowalencyjnego wiązania WA z PHGDH poprzez jego strukturę α-β-nienasyconego ketonu. Początkowo fragmenty α,β-nienasyconego ketonu WA zredukowano w celu wytworzenia WA-1 (patrz część Rysunek 3A). Późniejsze analizy z wykorzystaniem testów Cell Counting Kit-8 (CCK-8) i testów interakcji białek typu pull-down (patrz Figura 3B) wykazały, że działanie cytotoksyczne WA było rzeczywiście zależne od jego struktury α i β-nienasyconego ketonu. I odwrotnie, WA-1 nie zapobiegał skutecznie wiązaniu PHGDH z WP (patrz Figura 3C i D), tym samym dodatkowo potwierdzając kowalencyjne wiązanie β-nienasyconego ketonu z PHGDH (patrz Figura 3E).
Biorąc pod uwagę znaczącą rolę hamowania lub braku PHGDH w blokowaniu procesów szlaku syntezy seryny (SSP) w komórkach nowotworowych, autorzy przystąpili do badania wpływu WA na aktywność SSP w komórkach HCT-116 przy użyciu znakowania stabilnym izotopem U-13C-glukozy (patrz do rysunku 3J). Wyniki eksperymentów wykazały, że WA skutecznie hamuje aktywność SSP w komórkach HCT-116.
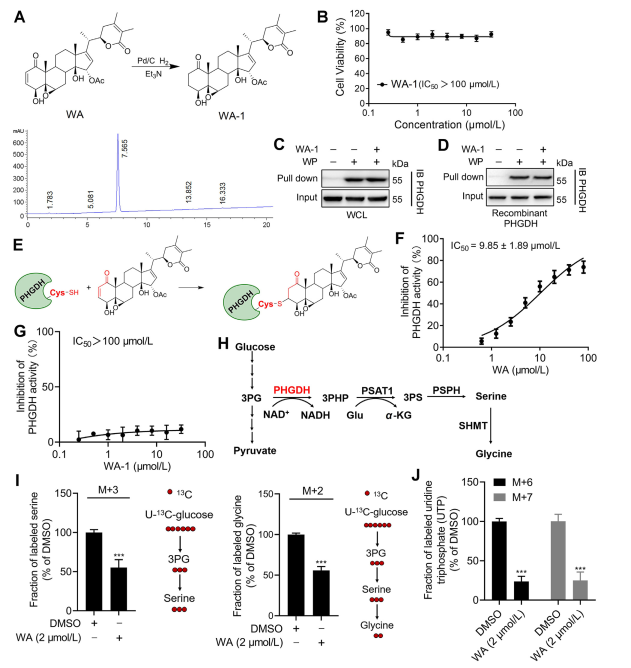
Rycina 3: WA kowalencyjnie wiąże się z PHGDH i hamuje aktywność PHGDH.
4. Reszta Cys295 PHGDH jest kowalencyjnie związana z WA.
Teoretycznie α i β-nienasycone grupy ketonowe WA mogą tworzyć kowalencyjne wiązanie z resztami cysteiny białka. Rzeczywiście, autorzy zaobserwowali kowalencyjną modyfikację reszt Cys295 w PHGDH przez WA. Następnie dostarczyli dalszych dowodów na kowalencyjne wiązanie WA z resztami Cys295 PHGDH i wykazali, że mutacje w Cys295 znacząco zmniejszają aktywność hamującą WA na PHGDH. Dodatkowo eksperymenty interferometrii biowarstwowej (BLI) wykazały brak interakcji pomiędzy WA i rekombinowanym białkiem Cys295A PHGDH, potwierdzając selektywne kowalencyjne wiązanie WA z PHGDH.
Co więcej, symulacje dynamiki molekularnej wykazały, że WA działa jako allosteryczny regulator PHGDH, a reszta Cys295 potencjalnie służy jako nowe miejsce allosteryczne dla PHGDH.
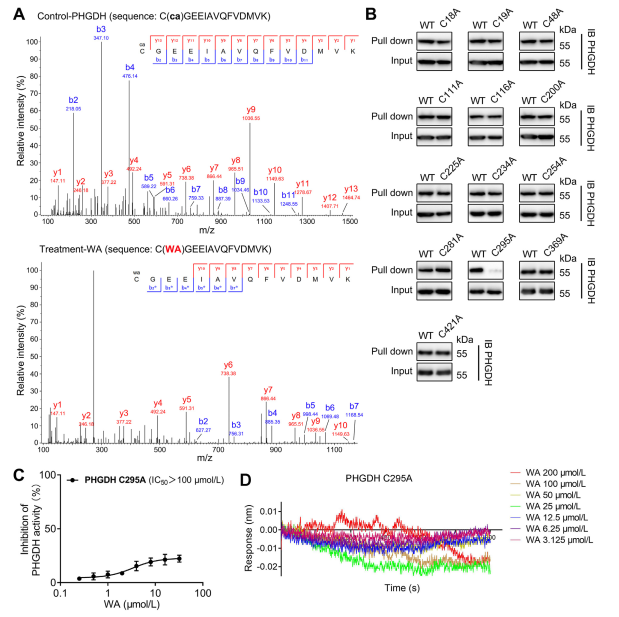
Rycina 4. WA Selektywnie kowalencyjnie wiąże się z resztami Cys295 PHGDH.
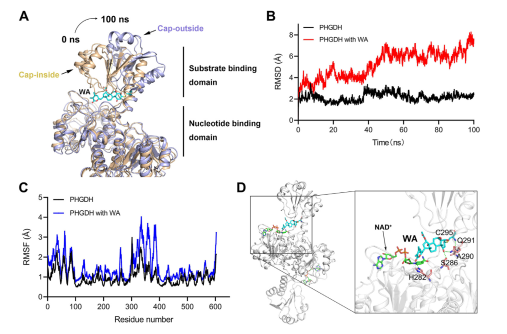
Rycina 5: Pozostałość Cys295 jako allosteryczne miejsce regulacyjne PHGDH
5. Wpływ WA na równowagę Redox w komórkach HCT-116.
Szlak syntezy seryny (SSP) odgrywa kluczową rolę w utrzymaniu komórkowej równowagi redoks, dostarczając prekursorów do syntezy glutationu (GSH) i wytwarzania NADPH, niezbędnych w reakcjach redoks. Autorzy zbadali wpływ WA na równowagę redoks w komórkach HCT-116 i zaobserwowali, że WA prowadzi do zwiększenia poziomu reaktywnych form tlenu (ROS), w konsekwencji zmniejszając stosunki GSH/GSSG i NADPH/NADP+, co wskazuje na podwyższony stres oksydacyjny.
Analiza Western blot ujawniła podwyższoną ekspresję γ H2AX, rozszczepionej kaspazy 3 i rozszczepionej PARP, wraz ze zmniejszoną ekspresją CHK2 i cykliny D1, co sugeruje indukcję apoptozy przez WA. Co więcej, utrata PHGDH skutkowała zwiększoną produkcją ROS, zahamowaniem proliferacji komórek HCT-116 i zmniejszoną cytotoksycznością WA w komórkach o niskiej ekspresji PHGDH. Odkrycia te podkreślają rolę PHGDH w wytwarzaniu ROS i cytotoksyczności za pośrednictwem WA w komórkach HCT-116.
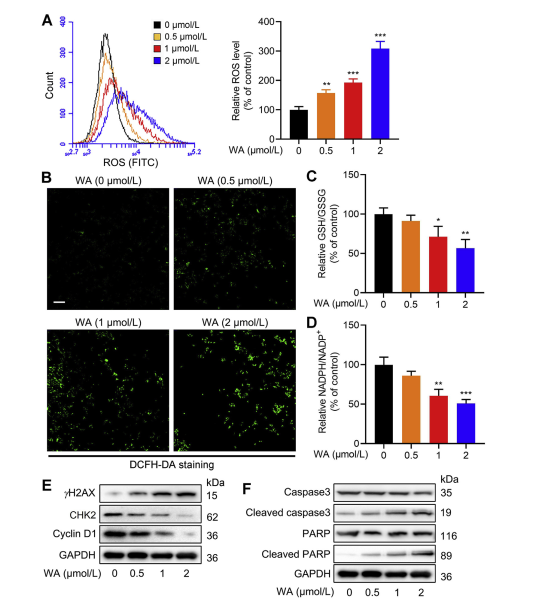
Rycina 6: WA zwiększa wewnątrzkomórkowe poziomy ROS w komórkach HCT-116
6. Efekt proliferacji komórek w modelach heteroprzeszczepów.
Aby ocenić wpływ WA na proliferację komórek HCT-116 in vivo, autorzy stworzyli model heteroprzeszczepu przy użyciu komórek HCT-116. Wyniki wykazały, że WA nie wykazuje znaczącego wpływu na masę ciała ani morfologię narządów, co wskazuje na niską toksyczność.
Aby dokładniej zbadać selektywność WA pod względem hamowania PHGDH, autorzy wygenerowali model heteroprzeszczepu przy użyciu komórek HCT116 z nokautem PHGDH (KO). W tym modelu brak PHGDH znacząco hamował proliferację komórek HCT-116 (patrz Figura 7, AC). Dodatkowo ekspresja Ki67, markera proliferacji komórek, została znacząco zmniejszona w modelu heteroprzeszczepu komórek PHGDH KO HCT116 (patrz Figura 7, D).
Warto zauważyć, że w modelu heteroprzeszczepu wykorzystującym komórki PHGDH KO HCT-116, WA nie wykazało znaczącego działania hamującego na proliferację komórek (patrz Figura 7, EG), co dodatkowo potwierdza, że hamujący wpływ WA na komórki HCT-116 zależy od PHGDH.
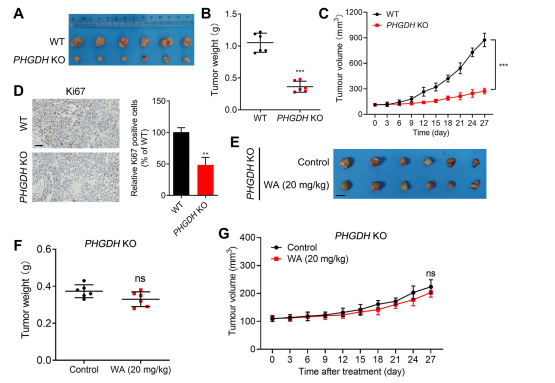
Rycina 7: Wpływ WA na proliferację komórek PHGDH KO HCT-116 in vivo
Wyniki tego badania nie tylko dostarczają kluczowych wskazówek dla przyszłego rozwoju leku przeciwnowotworowego dla PHGDH, ale także przynoszą nową nadzieję i potencjał w zakresie rozwoju nowego leku w dziedzinie terapii nowotworów.
Odniesienie:https://doi.org/10.1016/j.apsb.2021.06.008

