Análise ABPP revela novo mecanismo antiinflamatório do ácido itacônico por meio de interações proteína-metabólito
O itaconato, um metabólito endógeno crucial para a inflamação e a regulação imunológica, tem seu papel elucidado em um artigo conjunto da equipe da ChomiX Biotech. O estudo utilizou de forma inovadora a tecnologia ABPP para revelar que o itaconato modifica a S-glicosilação de resíduos de cisteína nas principais enzimas glicolíticas, impactando assim o metabolismo celular. Os pesquisadores mapearam as interações proteína-itaconato, descobrindo que o itaconato se liga e regula diretamente múltiplas enzimas na via da glicólise, afetando sua taxa e direção. Esta pesquisa avança nosso conhecimento dos mecanismos de controle metabólico durante a inflamação relacionada à doença e demonstra a força da ABPP em explorar como pequenas moléculas modulam as funções das proteínas. Como líder em proteômica química, a Corolus BioScience oferece soluções abrangentes, incluindo design de sondas, processamento de amostras, triagem de alto rendimento e análise de dados, para ajudar os clientes a descobrir mecanismos reguladores metabólicos semelhantes.
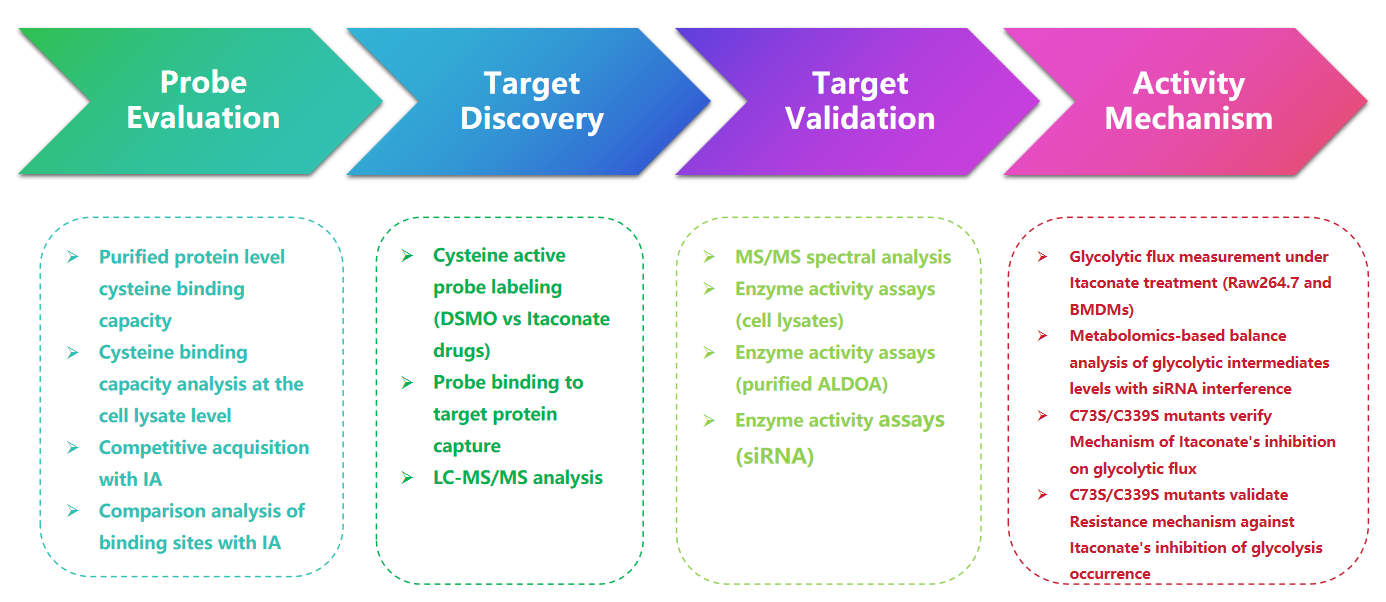
1. Detecção de modificações Itaconate com a sonda 1-OH-Az
Neste estudo, os autores empregaram técnicas avançadas de criação de perfil para investigar resíduos de cisteína direcionados ao itaconato. Eles inicialmente avaliaram a sonda 1-OH-Az por meio de eletroforese em gel e realizaram experimentos competitivos usando IA-alcino. A validação por espectrometria de massa confirmou que o 1-OH-Az marca seletivamente os locais de cisteína, com 87% das proteínas recentemente identificadas não documentadas anteriormente como proteínas de ligação ao ligante no DrugBank. Dadas as diversas funções e relevância para a doença destas proteínas, a sonda 1-OH-Az pode ser utilizada para identificar cisteínas activas como potenciais alvos de fármacos para novas terapêuticas.
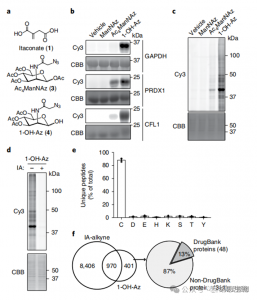
Figura 1: 1-OH-Az como uma sonda de análise de cisteína eficiente e distinta para detecção de modificações de itaconato
2. Identificação de sítios de modificação Itaconate usando técnicas proteômicas quantitativas
Os pesquisadores conduziram experimentos isoTOP-ABPP para quantificar resíduos de cisteína modificados por itaconato usando a sonda 1-OH-Az. Após o pré-tratamento do lisado, a proteômica quantitativa assistida por ligante marcada isotopicamente foi utilizada para analisar o impacto de diversas concentrações de itaconato, identificando seus alvos específicos. Experimentos comparativos também foram feitos usando duas concentrações de alcino IA, que, embora mostrando atividade e cobertura mais amplas, reconheceram apenas 65 e 50 locais concorrentes eficazes. Notavelmente, o 1-OH-Az demonstrou uma vantagem competitiva significativamente maior entre as cisteínas co-quantificadas.
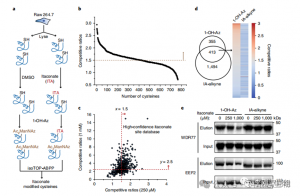
Figura 2: Análise Proteômica Química de Cisteínas Modificadas por Itaconato Utilizando isoTOP-ABPP Competitivo com 1-OH-Az
3. Itaconato modifica e inibe uma enzima glicolítica chave
A análise espectrométrica de massa revelou que o itaconato modifica três enzimas glicolíticas principais: ALDOA, GAPDH e LDHA. A modificação endógena do itaconato em Cys73 e Cys339 de ALDOA foi confirmada em células Raw264.7 estimuladas por LPS. Devido à proximidade, os autores especularam que tais modificações poderiam influenciar a atividade da aldolase. De facto, o tratamento com itaconato 1 mM levou à redução da actividade da enzima ALDOA sem afectar a expressão proteica. Além disso, análises isoTOP-ABPP mostraram que Cys84 em LDHA e Cys245 em GAPDH também são alvos para modificação de itaconato.

Figura 3: Itaconate pode modificar e prejudicar a função ALDOA
4. Itaconato suprime principalmente a glicólise, visando ALDOA
Para avaliar o papel regulador do ITAC na glicólise inflamatória de macrófagos, os autores monitoraram o consumo de glicose e a produção de lactato nas células Raw264.7 antes e depois da estimulação com LPS, demonstrando que o ITAC diminuiu significativamente ambos, indicando supressão da função glicolítica. Para validar o efeito do ITAC na ALDOA e subsequente inibição da glicólise, eles derrubaram a ALDOA endógena usando RNAi e superexpressaram WT ou ALDOA duplo mutante (C73S/C339S) em células Raw264.7. Como esperado, o knockdown do ALDOA resultou na diminuição do consumo de glicose e da produção de lactato, tornando as células insensíveis ao tratamento com ITAC. A reintrodução de WT ou ALDOA mutante restaurou os níveis metabólicos em células não tratadas; no entanto, as células que superexpressam o mutante ALDOA exibiram sensibilidade reduzida à inibição glicolítica em comparação com WT. Ensaios enzimáticos para atividade de aldolase alinhados com estados glicolíticos.
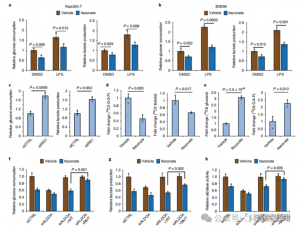
Figura 4: Itaconato altera a via glicolítica através da modificação do ALDOA
5. A inibição de ALDOA contribui para respostas antiinflamatórias
Estas descobertas revelaram que o ITAC suprime a atividade da via glicolítica modificando os resíduos de cisteína Cys73 e Cys339 no ALDOA. Os autores inferiram ainda da ação antiinflamatória conhecida do fumarato de dimetila por meio da modificação da cisteína no GAPDH e na inibição glicolítica que o ITAC pode, de forma semelhante, retroalimentar-se para interferir na glicólise para exercer um efeito antiinflamatório. O knockdown de ALDOA reduziu significativamente a secreção de IL-1β após estimulação com LPS, sugerindo seu envolvimento na regulação da inflamação através da glicólise. A reversão parcial dos efeitos antiinflamatórios do knockdown de ALDOA com piruvato suplementado indicou um papel limitado do LDHA nas respostas inflamatórias.
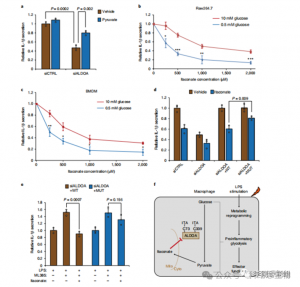
Figura 5: A ação antiinflamatória do itaconato é mediada pela inibição da ALDOA, resultando na interrupção da glicólise
Em resumo, este artigo aproveitou efetivamente tecnologias de perfil de cisteína baseadas em S-glicosilação e metodologias ABPP para construir uma rede de interações entre itaconato e proteínas relacionadas. Demonstra de forma convincente que o itaconato serve como um regulador metabólico crítico, modificando especificamente os resíduos de cisteína nas proteínas para controlar a via glicolítica. Esta pesquisa não apenas elucida o mecanismo de ação do itaconato como um novo regulador metabólico, mas também fornece evidências robustas de como pequenos metabólitos interagem com proteínas para modular as principais vias metabólicas.
Além da ABPP, outros métodos para estudar as interações entre metabólitos de moléculas pequenas e proteínas incluem, mas não estão limitados a:
1. Enriquecimento de afinidade (pull-down)técnicas, onde o composto nativo é convertido em uma sonda biotinilada que incuba com lisados celulares, seguido de enriquecimento mediado por estreptavidina e isolamento de alvos proteicos que se ligam à sonda de biotina.
2.Espectrometria de massa de proteólise limitada (LiP-MS)é uma tecnologia de descoberta de alvos baseada na afinidade protéica. Quando ligantes específicos, como medicamentos ou moléculas pequenas, se ligam a proteínas específicas, eles induzem alterações conformacionais ou obstáculos estéricos, levando a locais de clivagem diferenciais em comparação com a proteína não ligada. Ao detectar essas diferenças usando espectrometria de massa, este método pode identificar interações droga-proteína dentro das células e determinar os alvos moleculares da droga.
3.Ensaio de Mudança Térmica Celular (CETSA)foi inicialmente desenvolvido para auxiliar na pesquisa de alvos de medicamentos anticâncer e é um dos primeiros métodos sem rótulo amplamente utilizados para estudar o envolvimento de medicamentos em células intactas. CETSA baseia-se principalmente no princípio de que, ao ligar-se a uma proteína alvo, um composto aumenta a sua estabilidade térmica. Após incubação de amostras com o composto e controlos correspondentes a vários gradientes de temperatura, as proteínas ligadas ao ligando permanecem dobradas e relativamente estáveis após o aquecimento, enquanto as proteínas não ligadas se desdobram e precipitam devido à desnaturação. A análise subsequente da termoestabilidade da proteína solúvel através de abordagens baseadas em imunotransferência ou espectrometria de massa, com base nas suas curvas de fusão, confirma a interação entre o composto e as proteínas intracelulares.
4. Cromatografia de afinidadeenvolve a conjugação do metabólito alvo a uma matriz de fase sólida para capturar complexos proteicos que interagem com ele. As proteínas capturadas são então identificadas usando técnicas como espectrometria de massa.
5.Ressonância Plasmática de Superfície (SPR)é usado para medição em tempo real e sem rótulo de parâmetros cinéticos associados às interações entre pequenas moléculas e proteínas.
6. Cristalografia de proteínaselucida as estruturas tridimensionais de proteínas complexadas com ligantes de moléculas pequenas, fornecendo uma visão intuitiva dos locais de ligação e mecanismos de ação. Ao resolver essas estruturas, os pesquisadores podem visualizar diretamente como as pequenas moléculas interagem com seus alvos proteicos.

