Usando proteômica química para identificar o alvo funcional SLC25A20 do mebutato de ingenol para ceratose actínica
Este estudo utiliza proteômica química para revelar um novo alvo de macromorol metil butilato (Ing-Meb), um medicamento empregado no tratamento da ceratose solar. A equipe de pesquisa inicialmente desenvolveu e sintetizou uma sonda de fotoafinidade Ing-Meb chamada Ing-Dayne, que forma ligações covalentes com proteínas alvo após exposição à luz UV, facilitando a identificação de potenciais alvos funcionais. Através da validação subsequente, os autores identificaram o SLC25A20 como um alvo central do Ing-Meb. SLC25A20 é uma translocase de carnitina-acilcarnitina ligada à membrana mitocondrial envolvida no metabolismo de ácidos graxos. Notavelmente, a ação inibitória do Ing-Meb na função SLC25A20 leva ao aumento do acúmulo de acilcarnitinas de cadeia longa, comprovando que o Ing-Meb provoca seus efeitos terapêuticos modulando a via de oxidação dos ácidos graxos. Além disso, o estudo investiga a importância das modificações estruturais nas investigações de produtos naturais. Ao sintetizar a sonda de fotoafinidade Ing-Dayne através da modificação estrutural de Ing-Meb, os pesquisadores descobriram com sucesso um novo alvo distinto do entendimento convencional. Isto não só aumenta a compreensão do Ing-Meb e do seu modo de ação, mas também sublinha o papel fundamental da modificação estrutural na investigação proteómica química para desvendar as complexidades dos produtos naturais. Tais insights impulsionam ainda mais a inovação em medicamentos, abrangendo a otimização da eficácia dos medicamentos existentes, o desenvolvimento de novas terapias direcionadas a entidades específicas e a elucidação dos mecanismos de efeitos colaterais dos medicamentos.
Rota de Pesquisa
Processo experimental
1. O projeto da sonda de fotoafinidade sintética Ing-Dayne revela o mecanismo subjacente à ligação do medicamento para ceratose actínica Ing-Meb à sua proteína alvo.
Neste estudo, foi empregada a sonda de afinidade Ing-Dayne, derivada do medicamento terapêutico para ceratose actínica Ing-Meb (consulte a Figura 1). Através da co-cultura desta molécula sonda com células específicas e subsequente irradiação de luz UV, a estrutura dupla de acridina dentro da sonda formou ligações covalentes estáveis com proteínas intracelulares. Após a lise celular, uma reação química Click facilitou a ligação do grupo repórter azida-tetrametilrodamina à proteína alvo (como ilustrado na Figura 2). A análise subsequente de SDS-PAGE (representada na Figura 3) revelou que o Ing-Meb exibiu um efeito de ligação competitiva significativo na sonda, enquanto o Ingenol, possuindo uma estrutura semelhante, não demonstrou inibição competitiva.
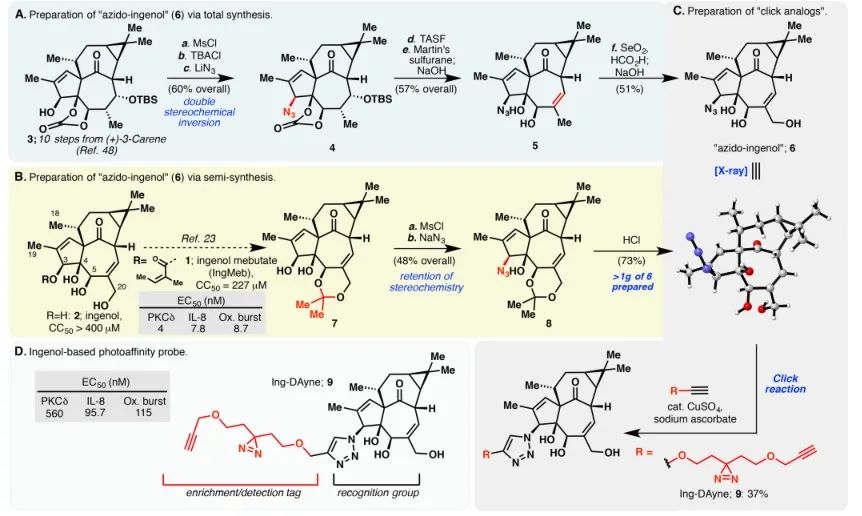
Figura 1: Ilustra as duas rotas sintéticas empregadas para a síntese de Ing-Dayne.
2. A nova sonda 11b identificou 44 proteínas alvo de BBR relacionadas à inflamação em células THP-1 e revelou EIF2AK2, eEF1A1, PRDX3 e VPS4B como alvos diretos com interações específicas com BBR.
Os autores, através de uma série de experimentos, empregaram com sucesso a nova sonda 11b para marcar e purificar potenciais proteínas alvo nas células THP-1. Em seguida, eles utilizaram a análise LC-MS/MS para identificar 44 proteínas associadas à inflamação na faixa de peso molecular de 20 a 80 kDa, entre as quais seis desempenharam papéis potencialmente críticos nas ações antiinflamatórias da BBR. Em investigações posteriores, EIF2AK2, eEF1A1, PRDX3 e VPS4B foram confirmados como alvos diretos da BBR, exibindo efeitos de inibição competitiva sob altas concentrações de tratamento com BBR. Esta descoberta revelou a provável existência de interações específicas entre estas proteínas e a BBR, elucidando assim novos conhecimentos sobre o seu envolvimento com o fármaco durante os seus processos anti-inflamatórios.
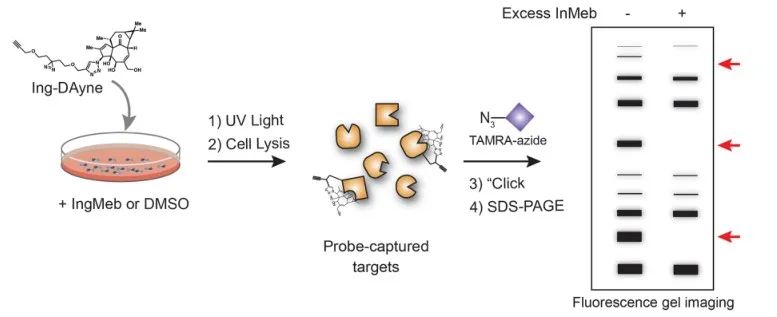
Figura 2: Processo de validação baseado em gel do alvo Ing-Dayne.
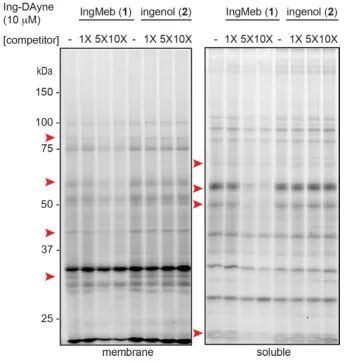
Figura 3: Inibição competitiva de Ing-Meb e ingenol na molécula sonda Ing-Dayne.
3. A triagem SILAC, combinada com a validação por Western blot, identificou o SLC25A20 como um alvo primário do medicamento da classe Ingenol, Ing-Meb.
Os autores inicialmente examinaram 28 proteínas-alvo potenciais usando a tecnologia Stable Isotope Labeling by Amino Acids in Cell Culture (SILAC) (Figura 4). Posteriormente, através de experimentos adicionais de triagem e validação de Western blot (Figura 5), os pesquisadores observaram que Ing-Meb exibiu o efeito inibitório mais forte sobre SLC25A20 entre esses alvos candidatos, sugerindo fortemente que SLC25A20 é um dos principais alvos funcionais de Ing-Meb.
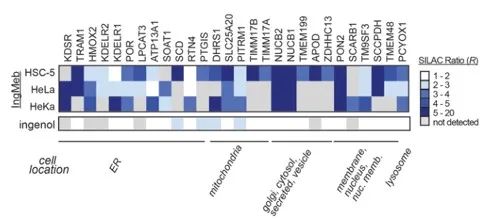
Figura 4: Os 28 alvos potenciais obtidos na triagem inicial.
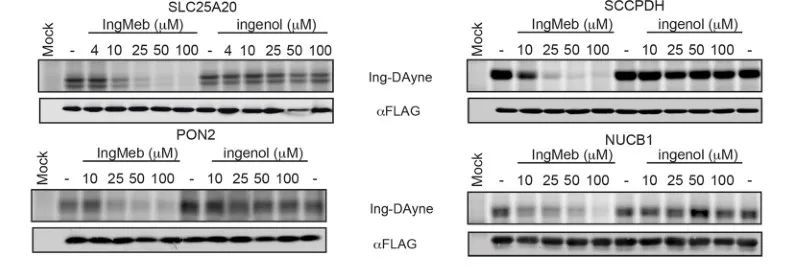
Figura 5: Experimentos de Western Blot de quatro potenciais proteínas alvo.
4. Ing-Meb regula a via de oxidação de ácidos graxos inibindo SLC25A20, uma proteína de membrana mitocondrial também conhecida como alcalilipoiltransferase botulínica, revelando assim seu alvo como um medicamento para ceratose actínica.
Os autores investigaram a SLC25A20, também conhecida como lipoiltransferase alcalina botulínica ou CACT, uma proteína de membrana integral multimodal localizada dentro da membrana mitocondrial. A sua função principal envolve o transporte de acilcarnitinas de cadeia longa para as mitocôndrias, facilitando a sua troca com a carnitina livre. Estas acilcarnitinas transportadas são subsequentemente convertidas em acilCoA graxo pela carnitina palmitoiltransferase-2 (CPT-2), servindo assim como precursores para a β-oxidação de ácidos graxos. Os resultados experimentais revelaram um aumento significativo no conteúdo celular de acilcarnitina de cadeia longa com concentrações crescentes do medicamento para ceratose actínica Ing-Meb (representado na Figura 6). Esta observação apoia fortemente o efeito inibitório do Ing-Meb no SLC25A20, confirmando assim o SLC25A20 como um dos principais alvos que medeiam a ação do Ing-Meb.
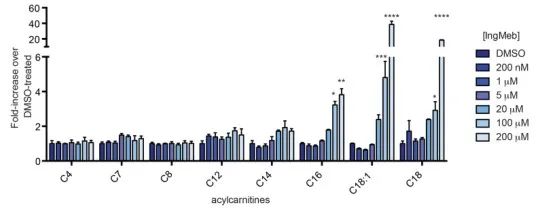
Figura 6: Efeito do Ing-Meb para acilcarnitinas de cadeia longa
5. Validação indireta do efeito citotóxico de Ing-Meb via expressão SLC25A20: revelando sua função alvo na regulação da atividade de medicamentos.
Os investigadores procuraram vincular diretamente a inibição do SLC25A20 nas células HeLa com os potenciais efeitos citotóxicos do Ing-Meb. Os resultados indicaram que, embora a superexpressão de SLC25A20 não tenha alterado a metade da concentração inibitória de Ing-Meb nessas células, é digno de nota que o aumento da expressão de SLC25A20 mitigou significativamente o impacto de Ing-Meb no acúmulo de acilcarnitina de cadeia longa (representado na Figura 7). . Este resultado corrobora ainda mais a hipótese de que o SLC25A20 serve como um alvo funcional essencial para a atividade medicamentosa do Ing-Meb.
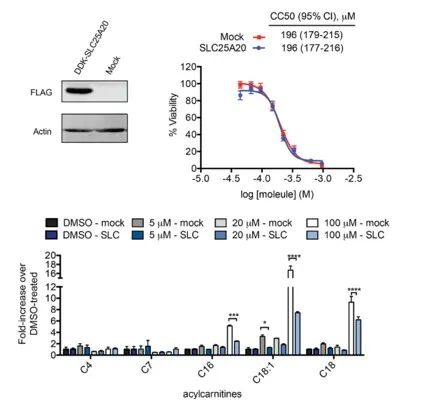
Figura 7: Efeito da expressão ou não de SLC25A20 em CC50 e acilcarnitina.
Este estudo não apenas revela os novos alvos do Ing-Meb, mas também fornece uma nova base teórica e direção estratégica para a descoberta de produtos naturais estruturalmente complexos. Referência:
Referência:https://doi.org/10.1021/acscentsci.7b00420.

