Antecedentes Técnicos
A tecnologia proteómica química surge como um farol de mudança, desviando a descoberta de medicamentos das proteínas purificadas para o domínio das células vivas.
A tecnologia proteômica química serve como uma plataforma robusta de descoberta de medicamentos, caracterizada pela investigação de pequenas interações molécula-proteína dentro de células vivas. Uma de nossas plataformas de descoberta de medicamentos covalentes foi projetada para descobrir ligantes covalentes que envolvem alvos proteicos por meio de reações covalentes com o grupo tiol de resíduos de cisteína. Ao contrário das estratégias tradicionais de triagem de alvo único, a plataforma proteômica química permite a análise quantitativa das interações entre fragmentos eletrofílicos e quase todas as proteínas em células vivas com a resolução de resíduos de aminoácidos. Possui cobertura em mais de 10.000 proteínas e~40.000 locais de cisteína (potenciais locais de ligação de drogas) de diversas linhagens celulares de mamíferos.

Fluxo de trabalho
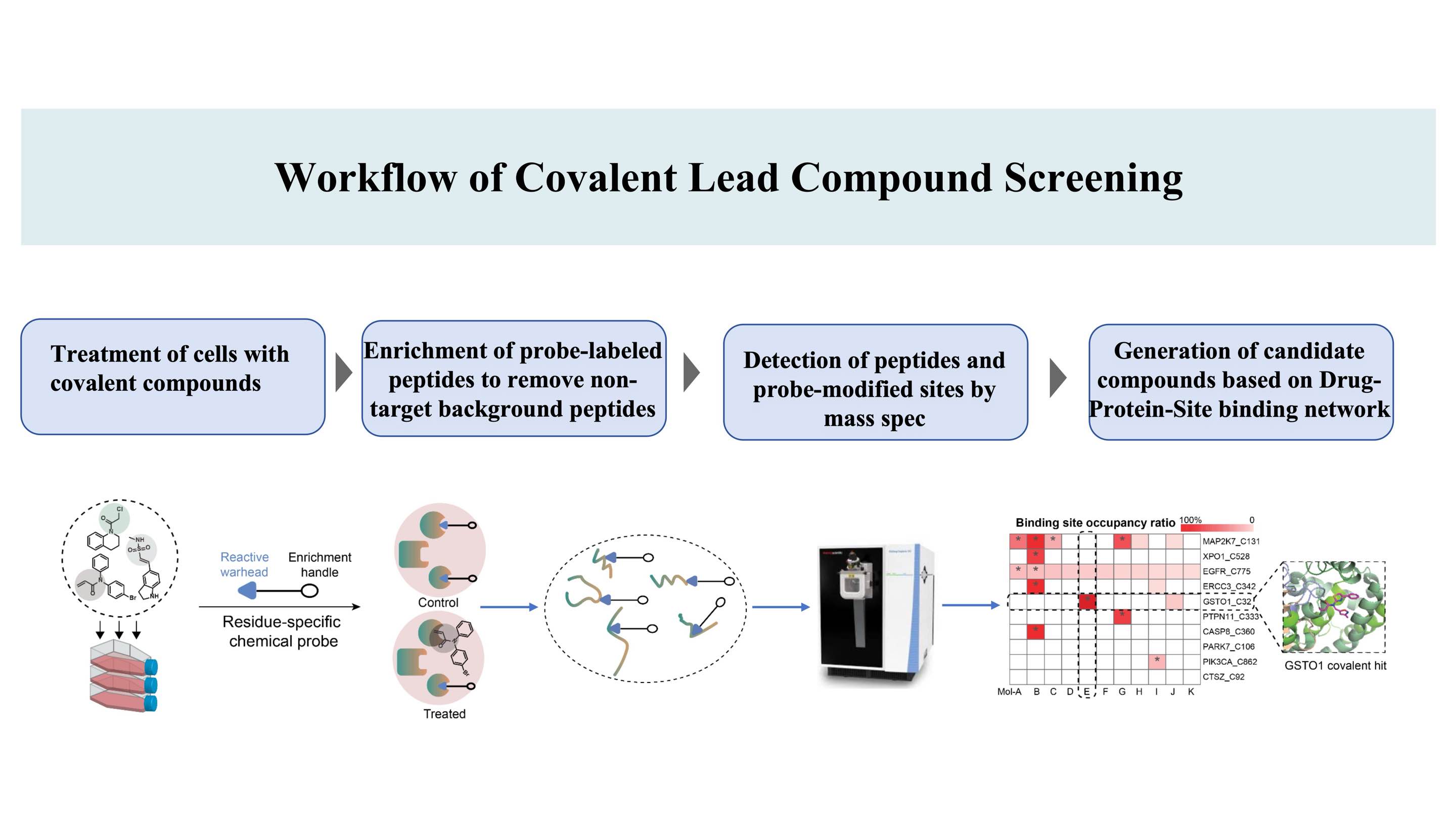
O fluxo de trabalho para descoberta de compostos covalentes direcionados a sítios de ligação* em proteínas, com base na patente DIA-ABPP (Data-Independent Acquisition-Activity-Based Protein Profiling) (Um sítio de ligação covalente é um aminoácido que pode ser marcado por sondas químicas, permitindo assim a ligandabilidade)
Vantagens Técnicas
Recurso 1
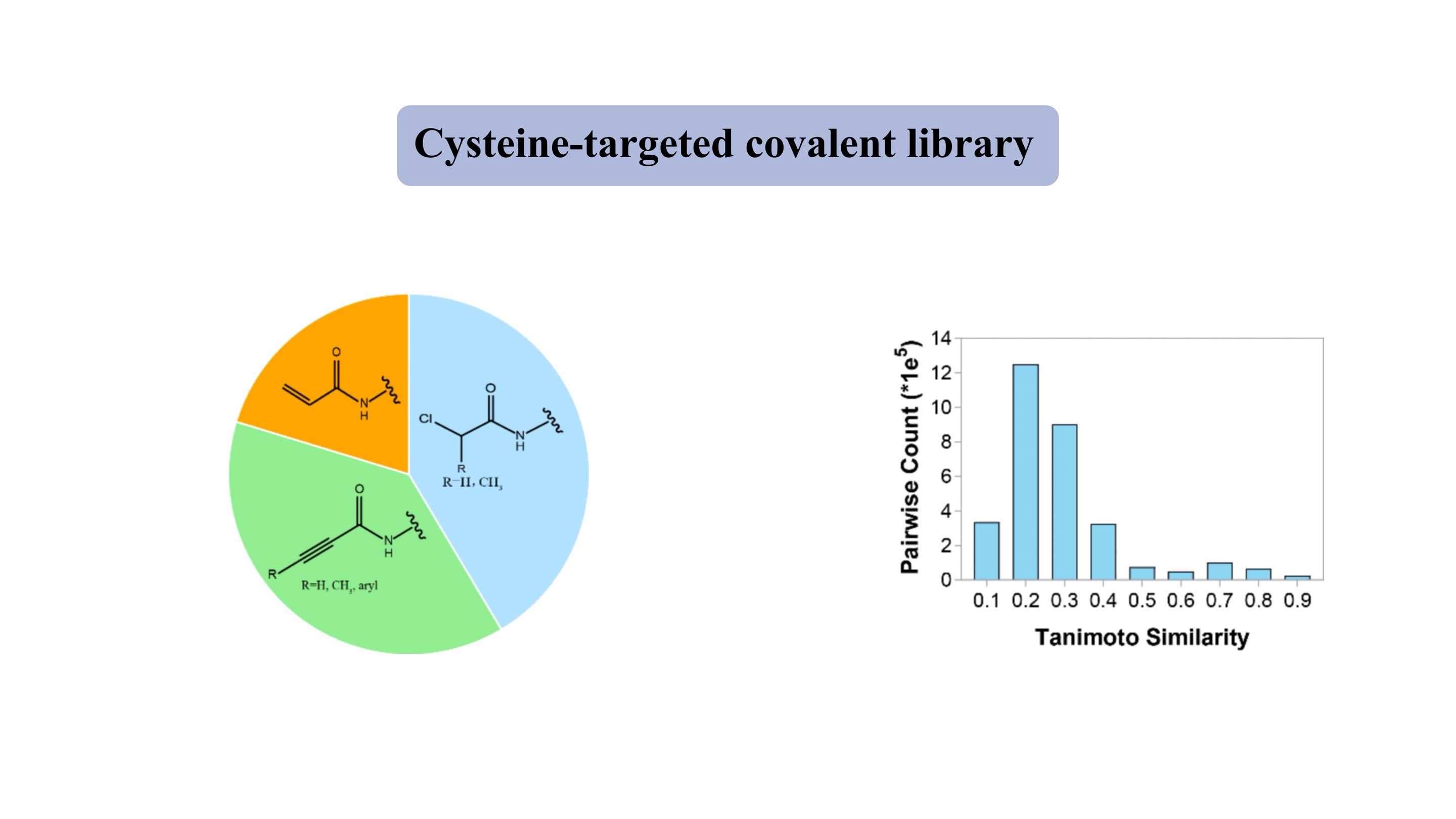
Biblioteca covalente direcionada à cisteína
A biblioteca covalente direcionada à cisteína contém “ogivas” eletrofílicas moderadas representativas, como acrilamidas e cloroacetamidas. A biblioteca “semelhante a drogas” contém ~ 3.000 compostos, com mais de 80% exibindo um peso molecular de 300-500 Da. Para a maioria dos compostos, o índice de similaridade de Tanimoto é de cerca de 0,3 para cada dois membros, indicando um alto grau de diversidade.
Recurso 2
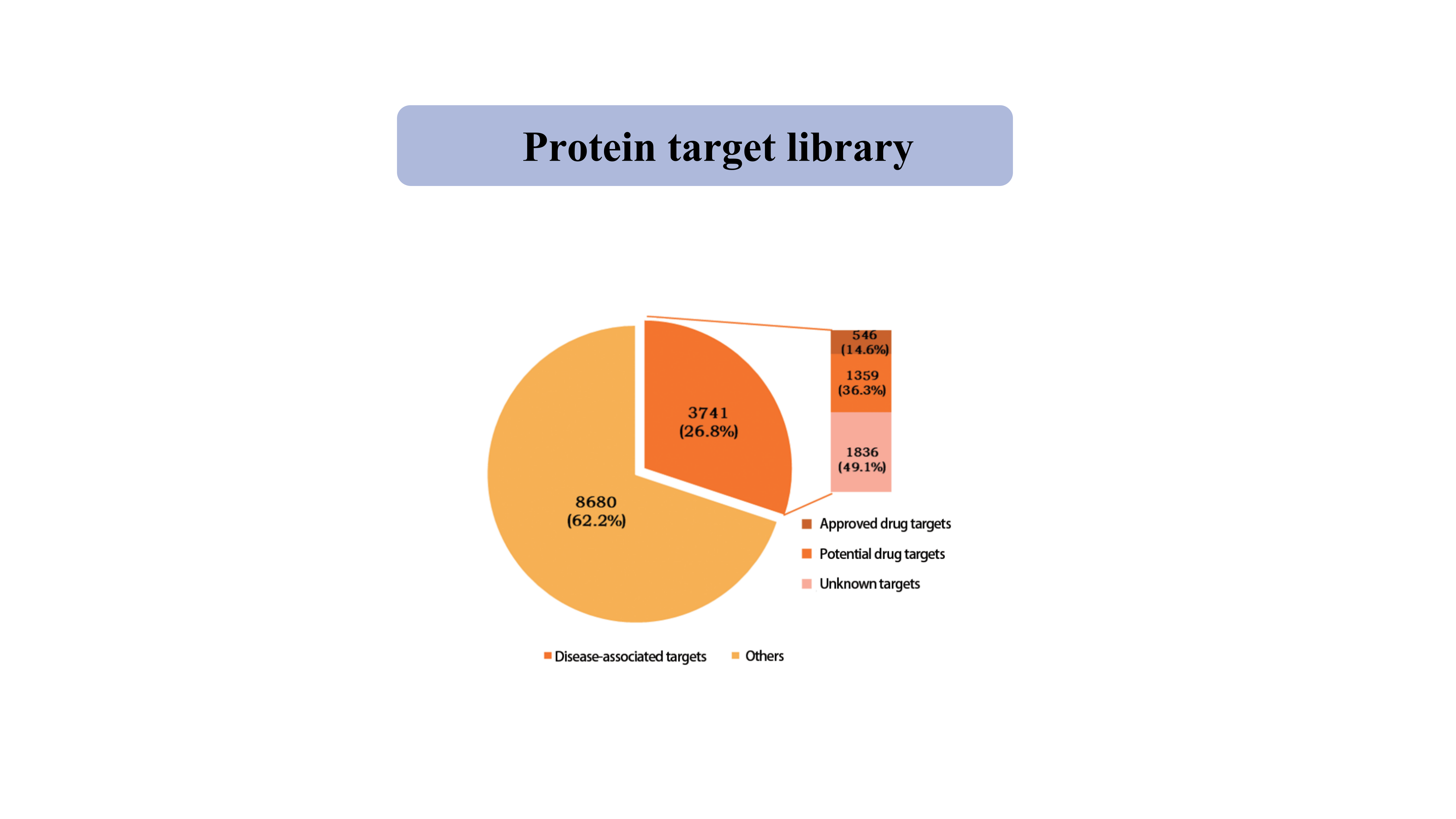
Alvo de proteínabiblioteca
Atualmente, a biblioteca de alvos proteicos capturados pela sonda química específica para tiol cobre 39.962 locais de cisteína de 12.421 proteínas, incluindo quinase, fosfatase, ligases e fatores de transcrição.
Estudo de caso
DCAF1 serve como receptor de substrato para duas ligases E3 distintas (CRL4DCAF1 e EDVP), desempenhando um papel fisiológico crítico na degradação de proteínas. Vários ligantes covalentes e não covalentes direcionados ao domínio WDR de DCAF1 foram desenvolvidos para apoiar aplicações de degradação direcionadas (Targeted Protein Degradation by Electrophilic PROTACs that Stereoselectively and Site-Specificically Engage DCAF1. J. Am. Chem. Soc. 2022, 144, 40, 18688 –18699. PROTACs baseados em DCAF1 com atividade contra alvos clinicamente validados. superando a resistência degradante intrínseca e adquirida.
Descobrimos pela primeira vez que o Mol-380 se envolve covalentemente com DCAF1_C69, destacando-o como um local potencial drogado para aplicações de TPD, separado do domínio WDR. Nossas descobertas destacam o valor significativo da plataforma proteômica química automatizada ChomiX na descoberta de novos ligantes para alvos não-drogáveis em células vivas, incluindo fatores transcricionais e proteínas de membrana, ressaltando seu impacto potencial no desenvolvimento de medicamentos e na exploração funcional.
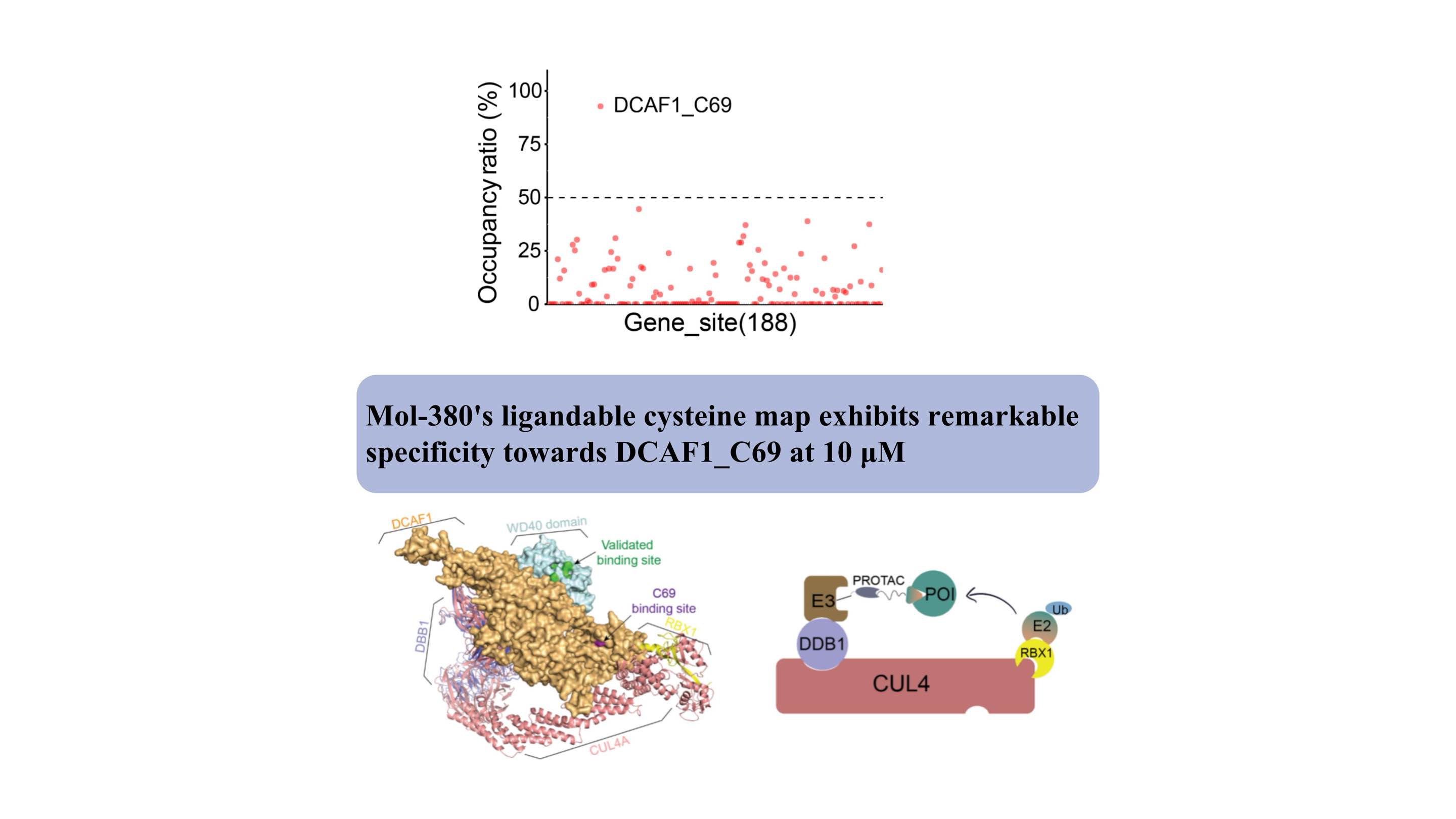
Estruturalmente, o sítio de ligação do C69 fica adjacente à bolsa validada no domínio WD40, conforme indicado pelo modelo complexo, oferecendo um novo sítio para o desenvolvimento de PROTACs.

