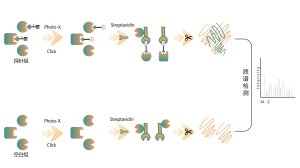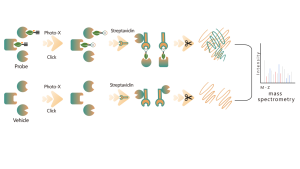Produtos
Análise ômica de modificações pós-traducionais de cisteína
A cisteína, com a sua notável reatividade, desempenha um papel fundamental na estrutura e função das proteínas. Servindo como reagente nucleofílico, centro catalítico redox, ligante de íons metálicos e local chave para mudanças conformacionais, ele participa extensivamente e influencia profundamente a atividade proteica e os mecanismos regulatórios. É importante notar que os resíduos de cisteína são propensos a sofrer vários tipos de modificações pós-traducionais (PTMs), que não apenas ajustam as propriedades funcionais das proteínas, mas também podem levar ao comprometimento funcional. Dada a estreita associação de tais modificações com inúmeras doenças humanas importantes, a análise qualitativa e quantitativa de PTMs de cisteína em proteínas é de suma importância. Isto tem um valor indispensável para uma compreensão aprofundada das funções biológicas de proteínas relevantes e dos seus mecanismos de acção nos estados de saúde e doença.
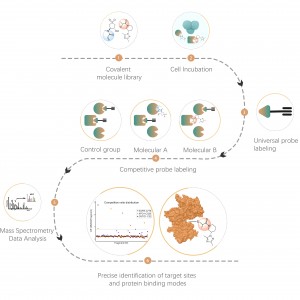
Chomix tem vasta experiência na identificação de modificações de cisteína, como a persulfidação de cisteína. Utilizando sondas universais de cisteína de forma inovadora com base na diferença de pKa entre -SH e -SSH, ajustamos o pH para reduzir a interferência de fundo de -SH, permitindo que as sondas rotulem predominantemente -SSH e, assim, identifiquem efetivamente os locais de sulfenilação.
Chomix possui tecnologia avançada de espectrometria de massa capaz de resolver direta e precisamente vários tipos de modificações pós-traducionais de proteínas e seus locais específicos. Através da integração inteligente de técnicas de separação e enriquecimento com rotulagem de isótopos e outros métodos avançados, possibilitamos análises qualitativas e quantitativas em larga escala e de alto rendimento de várias modificações, fornecendo suporte técnico robusto para pesquisas aprofundadas sobre modificações pós-traducionais de proteínas.

Nossas vantagens
1. Experiência Profissional: Com vasta experiência e publicações em periódicos importantes, oferecemos serviços personalizados para obter os melhores resultados.
2. Gestão de qualidade rigorosa: Nossos sistemas de qualidade maduros aderem aos padrões ISO9001, garantindo relatórios confiáveis.
3. Serviço abrangente: Do projeto da sonda à análise de bioinformática, fornecemos consultoria completa até a entrega, com atualizações oportunas do progresso.
4. Equipamento avançado: Equipados com espectrômetros de massa de última geração, como Thermo Fisher Orbitrap Exploris 480 e Bruker timsTOF, apoiamos pesquisas inovadoras.
Nosso serviço
| Projeto | Análise ômica de modificações pós-traducionais de cisteína |
| Amostra | Proteína pura, lisado celular, células vivas, tecido doente, sangue, bactérias, tecido vegetal |
| Plataforma de Hardware | Pulverizador de células ultrassônicas sem contato, sistema de imagem ChemiDoc MP, espectrômetro de massa Orbitrap Fusion Lumos Tribrid/Orbitrap Exploris 480/Q Exactive HF-X/timsTOF Pro 2 |
| Duração do Projeto | 4-8 semanas |
| Entregáveis | Relatório do Projeto (incluindo procedimentos experimentais, gráficos de análise de dados, resultados de análises de bioinformática) |
| Preço | Clique para consultar |
Estudo de caso
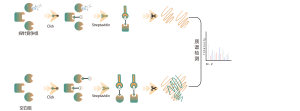
Tiolação refere-se ao acoplamento de um grupo tiol (-SSH) a resíduos de cisteína em proteínas, mediado por sulfeto de hidrogênio (H2S). Para investigar ainda mais este processo, proteomas inteiros podem ser extraídos de amostras de células ou tecidos e rotulados usando um método de sonda química (sonda específica para cisteína). Ao contrário da interferência tiol, este método permite a marcação eficaz de grupos tiol ajustando com precisão o pH. Posteriormente, com o auxílio da espectrometria de massa de alta resolução, os pesquisadores podem identificar com precisão os locais de tiolação, elucidando ainda mais o importante papel desta modificação pós-tradução in vivo.
Usando modelos de células HeLa, todo o proteoma foi extraído pela primeira vez. Posteriormente, a modelagem com NaHS e ajuste de pH permitiu a marcação precisa de grupos tiol por uma sonda universal de cisteína. Através de uma série de etapas, incluindo enriquecimento, digestão enzimática e detecção por espectrometria de massa, foram identificados 180 peptídeos contendo modificações -SSH, juntamente com 120 proteínas relacionadas, incluindo os sítios de tiolação relatados GAPDH_C152 e C247.

Aqui estão os espectros MS/MS de peptídeos com modificações -SSH: