[Financiamento de projeto chave nacional] Desvendando proteínas de ligação a metais: avanços no METAL-TPP e inovações na descoberta de medicamentos
As proteínas de ligação a metais são componentes cruciais que formam complexos estáveis com íons metálicos, servindo a várias funções vitais nos organismos vivos, incluindo sinalização celular, catalisando reações bioquímicas e mantendo a homeostase dos íons metálicos. Sua desregulação está associada a doenças como câncer, distúrbios neurológicos e doenças metabólicas. Compreender o seu papel na patogênese da doença é fundamental para o diagnóstico e tratamento. Além disso, as proteínas de ligação a metais são alvos importantes no desenvolvimento de medicamentos, uma vez que muitos medicamentos interagem com elas para exercer efeitos terapêuticos. Neste estudo, os pesquisadores introduziram o METAL-TPP, um método proteômico químico de última geração. Combinando a análise proteômica quantitativa de termoestabilidade (TPP) com a identificação de proteínas de ligação a metais, o METAL-TPP permite a detecção eficiente e precisa de proteínas de ligação a metais. Notavelmente, regula a termoestabilidade das proteínas usando uma variedade de quelantes metálicos, facilitando a identificação precisa em proteínas puras e lisados celulares. Esta abordagem inovadora oferece novos insights sobre a função e os mecanismos das proteínas de ligação a metais, auxiliando na pesquisa biológica, na compreensão de doenças e no desenvolvimento de medicamentos. A Keloxi Biology fornece ABPPs avançados, TPP e outros serviços técnicos em P&D farmacêutico, apoiando pesquisadores na exploração de mecanismos de medicamentos e no avanço de processos de desenvolvimento de novos medicamentos.

Processo experimental
1. Dezessete potenciais proteínas de ligação a metais foram identificadas usando METAL-TPP.
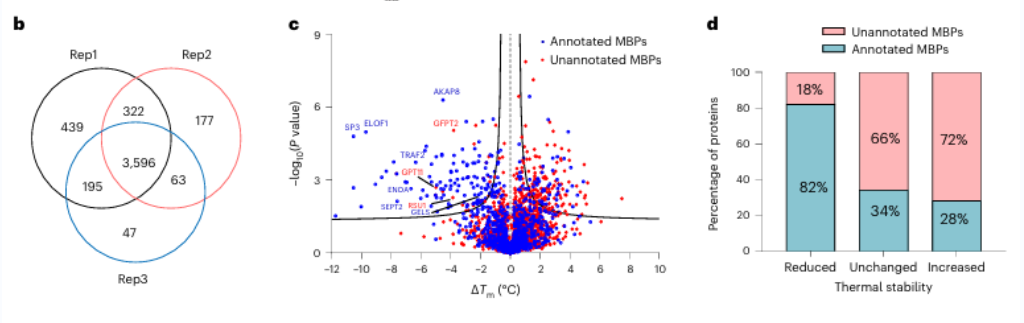
Inicialmente, os pesquisadores avaliaram a eficácia da quelação de metais de amplo espectro usando EDTA em proteínas puras e lisados celulares. Eles observaram que o METAL-TPP detectou efetivamente reduções na estabilidade térmica de proteínas de ligação a metais. Posteriormente, foi realizada uma análise sistemática em proteínas de origem humana utilizando METAL-TPP, identificando 125 proteínas que apresentavam termoestabilidade diminuída. Entre estas, 102 eram proteínas de ligação a metais anteriormente conhecidas. Além disso, foram descobertas 17 proteínas potenciais de ligação a metais sem anotação funcional prévia, oferecendo novos insights sobre o papel das proteínas de ligação a metais.
2. O efeito dos íons zinco na potencial proteína de ligação ao metal GFPT2.
Entre essas 17 proteínas potenciais de ligação a metais, os pesquisadores optaram por realizar uma validação bioquímica aprofundada na proteína GFPT2. GFPT1/2 atua como a primeira enzima limitante da taxa na via de biossíntese da hexose, auxiliando na geração de uma substância chamada UDP-GlcNAc. Os investigadores confirmaram a nível celular que os iões de zinco interagem com o GFPT2, inibindo a sua atividade. Além disso, observaram que a presença de íons zinco leva a uma redução significativa nos níveis de UDP-GlcNAc, indicando que os íons zinco regulam a via de biossíntese da hexose, inibindo a atividade do GFPT2. Curiosamente, os íons zinco exibem seletividade diferente na inibição das atividades de GFPT2 e GFPT1, sugerindo a presença de um novo mecanismo regulatório.
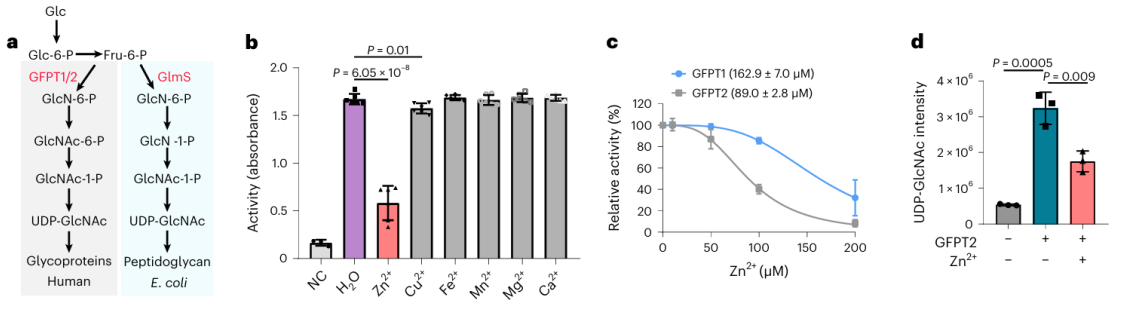
3. Decifrar o mecanismo molecular dos íons zinco na atividade da enzima GFPT2 e GLMS.
Os pesquisadores isolaram o homólogo da proteína GFPT2 de E. coli e prosseguiram com uma série de experimentos bioquímicos e análises de estrutura cristalina. As descobertas revelaram que a proteína GLMS tem a capacidade de se ligar a iões de zinco e, nomeadamente, esta ligação ocorre perto da região de ligação ao substrato. Isto sugere um cenário potencial onde os íons zinco poderiam competir pela ligação no sítio ativo de GLMS e GFPT2, ou dificultar a atividade de ambas as enzimas formando ligações de coordenação com seus sítios ativos.

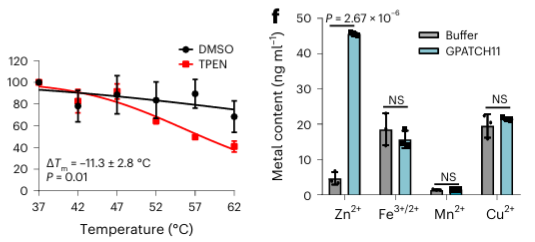
4.O quelante de metal TPEN pode reconhecer especificamente proteínas de ligação a íons de zinco.
Finalmente, os pesquisadores ampliaram a capacidade do METAL-TPP de identificar proteínas de ligação a metais em proteínas humanas usando o quelante metálico TPEN. Os resultados experimentais revelaram que entre as 150 proteínas com estabilidade térmica reduzida, 110 (73%) eram proteínas de ligação a metais conhecidas, indicando que o TPEN, tal como o EDTA, pode reconhecer especificamente proteínas de ligação a metais. Entre estas, 95 (86%) das proteínas de ligação a metais conhecidas eram proteínas de ligação a íons de zinco, enquanto apenas 41% das proteínas com estabilidade térmica reduzida causada por EDTA eram proteínas de ligação a íons de zinco, sugerindo a preferência do TPEN para identificar íons de zinco. -proteínas de ligação.
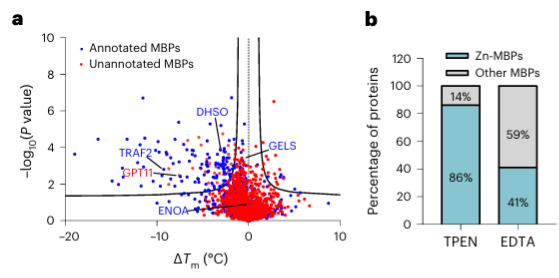
Entre as 40 potenciais proteínas de ligação a metais identificadas, os autores selecionaram uma proteína alvo, GPATCH11, para validação bioquímica preliminar e descobriram que esta proteína é uma proteína de ligação ao íon zinco.
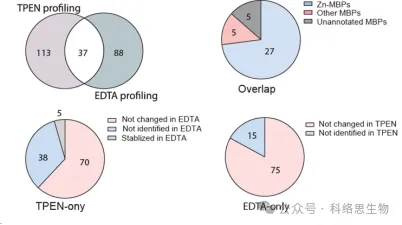
5. Comparação da capacidade de reconhecimento de dois quelantes metálicos em METAL-TPP.
Os pesquisadores também compararam a capacidade de dois quelantes metálicos, TPEN e EDTA, de identificar proteínas com estabilidade térmica reduzida em dados proteômicos do METAL-TPP. Eles descobriram que entre as 37 proteínas identificadas por ambos os quelantes, 27 eram conhecidas por se ligarem ao zinco, 5 eram conhecidas por se ligarem a outros metais e 5 não eram previamente anotadas como proteínas de ligação a metais. Para proteínas cuja estabilidade térmica diminuiu sob um quelante e permaneceu inalterada ou aumentada sob o outro, os pesquisadores sugeriram duas possíveis razões para a diferença na faixa de identificação pelo METAL-TPP. Primeiro, cada quelante pode atuar como um ligante de ligação em algumas proteínas, tornando-as mais estáveis e neutralizando o efeito desestabilizador causado pela ligação ao metal. Em segundo lugar, devido às diferentes estruturas moleculares, os dois quelantes também têm solubilidades em água muito diferentes. Assim, futuros estudos de METAL-TPP podem ser realizados utilizando outros quelantes com estruturas moleculares únicas para explorar de forma mais abrangente o escopo do metaloproteoma.
No geral, este estudo introduziu um novo método, METAL-TPP, que serve como uma ferramenta potente para a realização de investigações proteômicas de ligação de metais. Através desta abordagem, os investigadores identificaram sistematicamente proteínas de ligação a metais e elucidaram os seus papéis nas funções biológicas e na patogénese. Este esforço não só estabelece bases de dados importantes, mas também fornece informações valiosas para a compreensão das funções bioquímicas e do potencial de desenvolvimento de medicamentos das proteínas de ligação a metais, promovendo assim mais pesquisas em áreas relacionadas.
Referência:,https://www.nature.com/articles/s41589-024-01563-y.

