Desvendando o mistério da pequena molécula WA: lançando luz sobre a regulação da enzima PHGDH e abrindo caminho para novas terapias anticâncer
A serina, um aminoácido indispensável, cumpre várias funções biológicas cruciais nos organismos vivos. Não só serve como componente fundamental na síntese protéica, mas também participa na regulação de inúmeras vias metabólicas, incluindo síntese de nucleotídeos, metabolismo da metionina e funções antioxidantes. Entre essas vias, a fosfopiruvato desidrogenase (PHGDH) tem importância fundamental, pois catalisa a etapa inicial da via de síntese de serina, convertendo 3-fosfoglicerato em 3-fosfohidroxipiruvato. Dado o seu papel central no metabolismo da serina, qualquer aberração na função do PHGDH está intrinsecamente ligada ao aparecimento e progressão de inúmeras doenças, particularmente o cancro.
Este artigo apresenta uma abordagem inovadora que utiliza proteômica química e técnicas de análise fenotípica para identificar um composto capaz de inibir covalentemente o PHGDH. Embora a maioria dos inibidores de PHGDH sejam tipicamente de natureza competitiva, os autores apresentam a Withangulatina A (WA), uma pequena molécula natural, como um novo inibidor covalente de PHGDH. WA surge como um composto líder promissor para o desenvolvimento de inibidores de PHGDH. Além disso, WA serve como uma sonda valiosa para investigar a funcionalidade do PHGDH e da via de síntese de serina (SSP). Aproveitando este inibidor, os investigadores obtêm conhecimentos mais profundos sobre os mecanismos reguladores que regem o metabolismo da serina, abrindo assim caminhos para explorar potenciais modalidades de tratamento para doenças relacionadas, nomeadamente o cancro.
Esta descoberta não só oferece direções promissoras para o desenvolvimento de novas estratégias de tratamento medicamentoso, mas também fornece informações cruciais sobre o papel do metabolismo da serina na progressão da doença.
Rota de Pesquisa
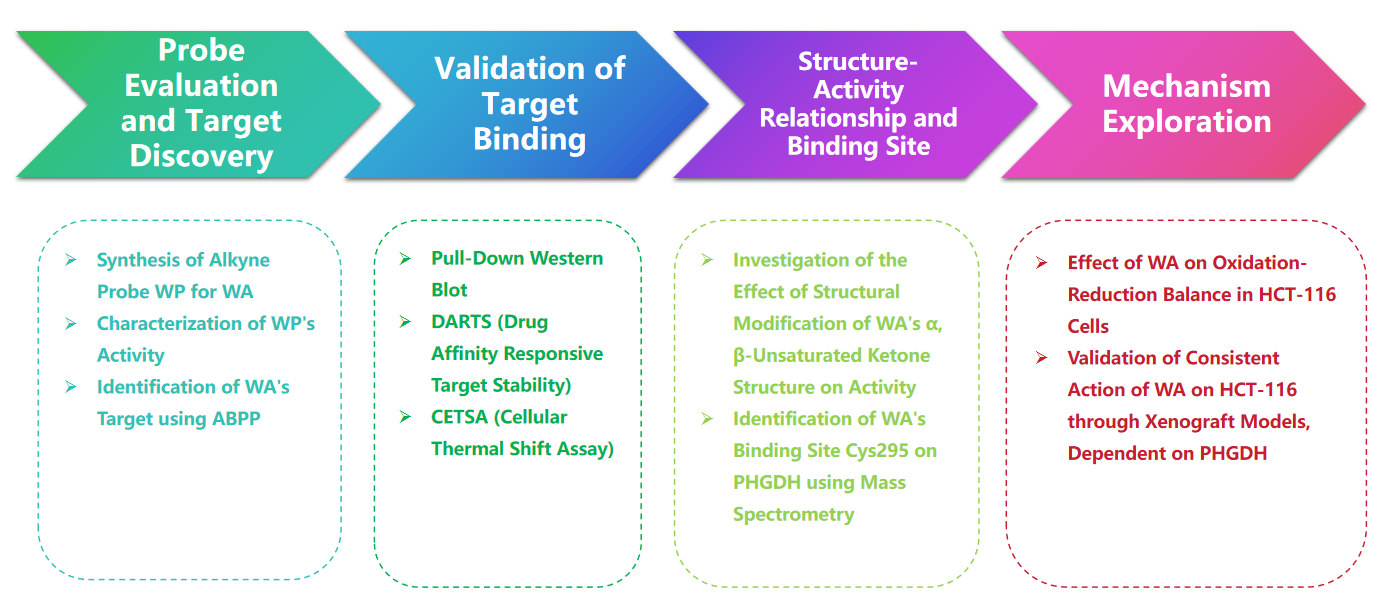
Processo experimental
1. Comparação de WP e WA nos experimentos de citotoxicidade.
No estudo, o autor desenvolveu e sintetizou uma sonda composta denominada WP. Empregando células de cancro do cólon humano (HCT-116) e células normais do cólon (NCM460), os autores observaram que o WP exibia citotoxicidade comparável à WA. Isto sugere que a inclusão de marcadores alcinos não alterou significativamente os seus efeitos citotóxicos. Além disso, os autores observaram que o WA apresentava menor citotoxicidade nas células normais do cólon, mas maior citotoxicidade nas células cancerígenas do cólon, sublinhando a sua maior seletividade em relação às células cancerígenas do cólon.
Posteriormente, os autores empregaram uma estratégia de Perfil Proteico Baseado em Atividade (ABPP), utilizando a sonda WP em células HCT-116. Esta abordagem levou à identificação do PHGDH como uma proteína alvo direta do WA. A validação experimental foi realizada utilizando ensaios WB-pull down, confirmando os achados.
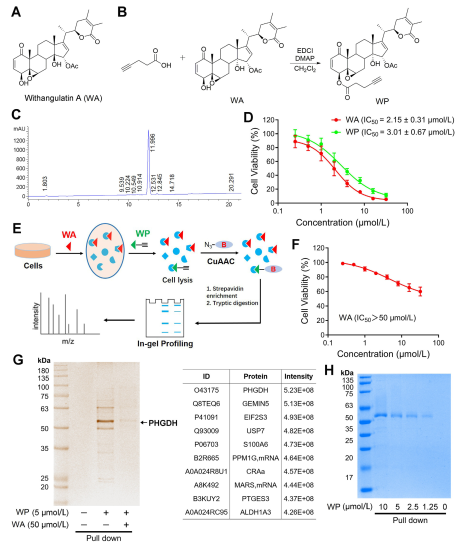
Figura 1: Abordagem Proteômica Química para Identificar Alvos da Withangulatina A.
2. Confirmação da interação direta entre WA e PHGDH.
Utilizando a tecnologia Activity-Based Protein Profiling (ABPP), os autores identificaram o PHGDH como um alvo direto do composto WA em células HCT-116. Para validar a interação entre WA e PHGDH, os autores conduziram experimentos de estabilidade de alvo responsivo à afinidade de drogas (DARTS) e ensaio de mudança térmica celular (CETSA). Os resultados demonstraram que o WA melhorou a estabilidade térmica do PHGDH e inibiu significativamente a sua atividade. Além disso, experimentos de Interferometria de Biocamada (BLI) forneceram confirmação adicional da interação direta entre WA e PHGDH.
Os autores também investigaram a natureza irreversível da ligação do WA ao PHGDH. Seus experimentos revelaram que o PHGDH impediu a ligação do WP; entretanto, a pré-incubação com soluções contendo N-acetilcisteína (NAC) ou glutationa (GSH) poderia reverter a ligação do WP ao PHGDH. Estes resultados sugerem uma ligação covalente irreversível entre resíduos de WA e cisteína na proteína PHGDH.
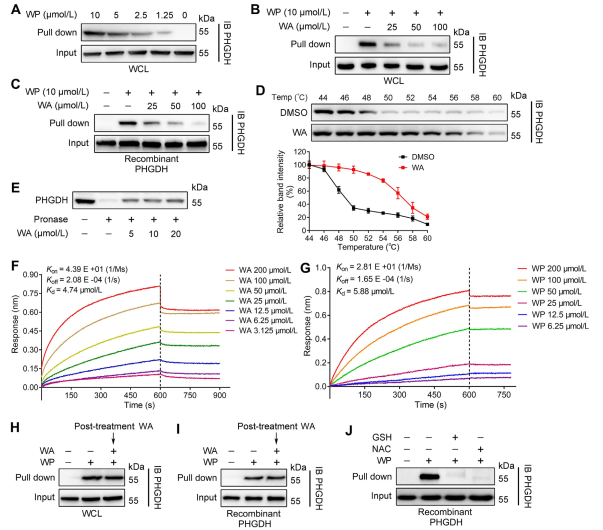
Figura 2: WA se liga diretamente ao PHGDH.
3. WA liga-se covalentemente a PHGDH através da porção cetona α - β-insaturada.
Para elucidar ainda mais o mecanismo pelo qual o WA interage com o PHGDH, os investigadores conduziram experimentos para confirmar a ligação covalente do WA ao PHGDH através de sua estrutura de cetona α-β-insaturada. Inicialmente, os fragmentos de cetona α, β-insaturados de WA foram reduzidos para produzir WA-1 (consulte a Parte Figura 3A). Análises subsequentes usando ensaios Cell Counting Kit-8 (CCK-8) e ensaios de interação de proteínas pull-down (consulte a Figura 3B) demonstraram que o efeito citotóxico de WA era de fato dependente de sua estrutura de cetona α e β-insaturada. Por outro lado, WA-1 não conseguiu prevenir eficazmente a ligação de PHGDH a WP (consulte a Figura 3C e D), confirmando ainda mais a ligação covalente da cetona β-insaturada a PHGDH (consulte a Figura 3E).
Dado o papel significativo da inibição ou ausência de PHGDH no bloqueio dos processos da via de síntese de serina (SSP) em células tumorais, os autores procederam à investigação do efeito de WA na atividade de SSP em células HCT-116 usando marcação com isótopo estável de glicose U-13C (consulte conforme Figura 3J). Os resultados experimentais revelaram que o WA inibiu eficazmente a atividade do SSP nas células HCT-116.
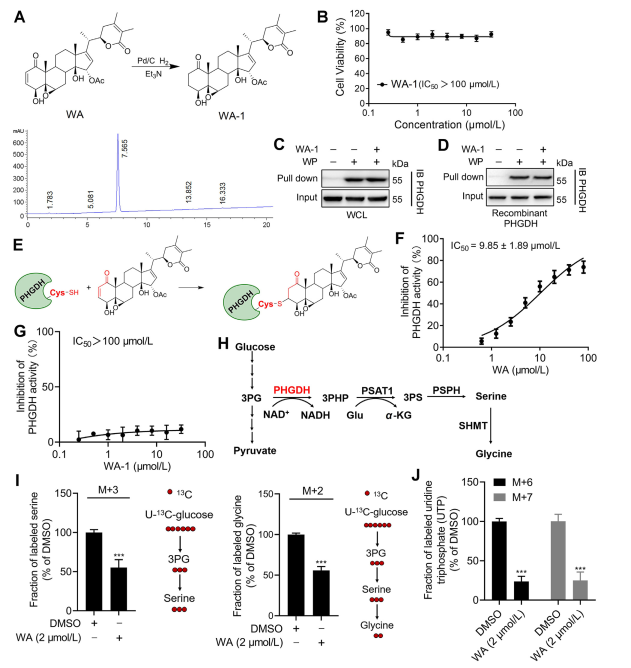
Figura 3: WA se liga covalentemente ao PHGDH e inibe a atividade do PHGDH.
4. O resíduo Cys295 de PHGDH está covalentemente ligado a WA.
Teoricamente, as porções cetona α e β-insaturadas de WA podem formar uma ligação covalente com resíduos de cisteína da proteína. De facto, os autores observaram modificação covalente dos resíduos Cys295 em PHGDH por WA. Posteriormente, eles forneceram evidências adicionais da ligação covalente do WA aos resíduos Cys295 do PHGDH e demonstraram que as mutações no Cys295 reduziram significativamente a atividade inibitória do WA no PHGDH. Além disso, experimentos de Interferometria de Biocamada (BLI) não revelaram interação entre WA e a proteína Cys295A PHGDH recombinante, confirmando a ligação covalente seletiva de WA a PHGDH.
Além disso, simulações de dinâmica molecular indicaram que o WA funciona como um regulador alostérico do PHGDH, com o resíduo Cys295 servindo potencialmente como um novo sítio alostérico para o PHGDH.
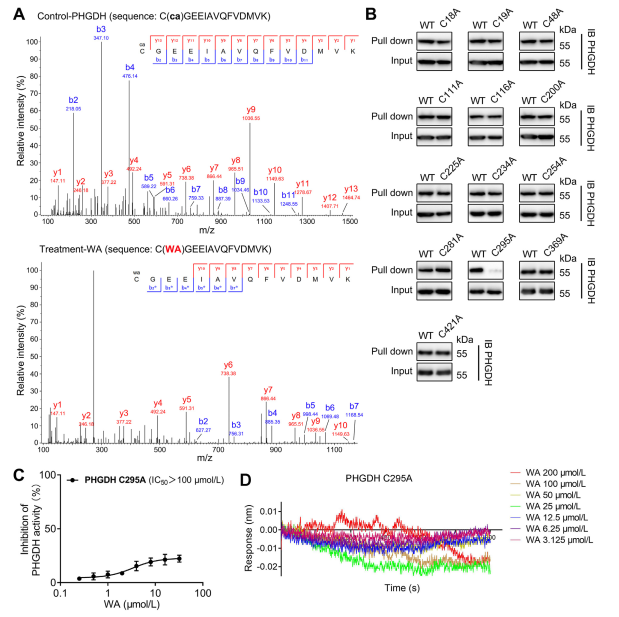
Figura 4. WA liga-se seletivamente de forma covalente aos resíduos Cys295 de PHGDH.
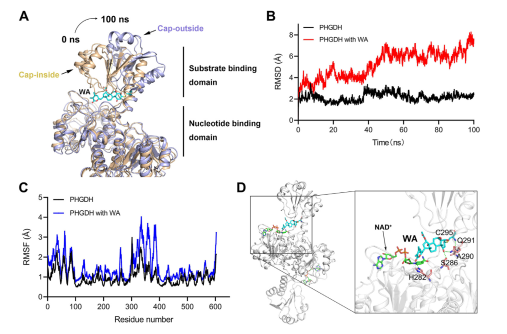
Figura 5: Resíduo Cys295 como sítio regulador alostérico de PHGDH
5. O efeito do WA no equilíbrio redox em células HCT-116.
A via de síntese de serina (SSP) desempenha um papel fundamental na manutenção do equilíbrio redox celular, fornecendo precursores para a síntese de glutationa (GSH) e produção de NADPH, essenciais para reações redox. Os autores investigaram o impacto do WA no equilíbrio redox em células HCT-116 e observaram que o WA levou ao aumento dos níveis de espécies reativas de oxigênio (ROS), reduzindo consequentemente as relações GSH/GSSG e NADPH/NADP+, indicativas de aumento do estresse oxidativo.
A análise de Western blot revelou expressão elevada de γ H2AX, caspase3 clivada e PARP clivada, juntamente com diminuição da expressão de CHK2 e ciclina D1, sugerindo indução de apoptose por WA. Além disso, a perda de PHGDH resultou no aumento da produção de ERO, inibiu a proliferação de células HCT-116 e reduziu a citotoxicidade de WA em células com baixa expressão de PHGDH. Estas descobertas sublinham o papel do PHGDH na produção de ROS e na citotoxicidade mediada por WA em células HCT-116.
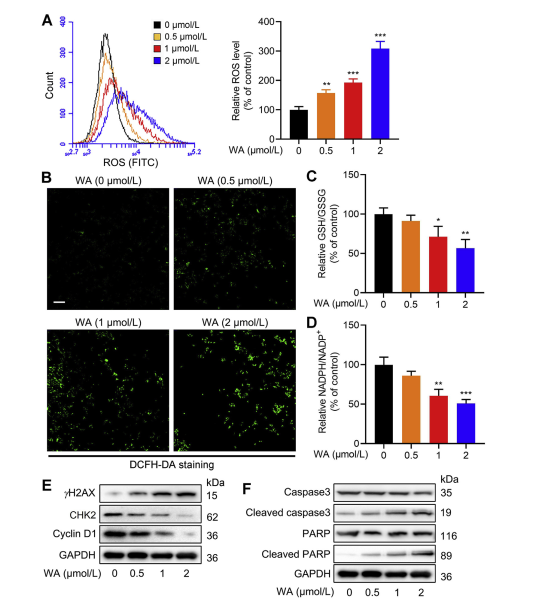
Figura 6: WA aumenta os níveis intracelulares de ROS em células HCT-116
6. Efeito da proliferação celular em modelos de xenoenxerto.
Para avaliar o impacto do WA na proliferação de células HCT-116 in vivo, os autores estabeleceram um modelo de xenoenxerto utilizando células HCT-116. Os resultados revelaram que o WA não apresentou efeitos significativos no peso corporal ou na morfologia dos órgãos, indicando baixa toxicidade.
Para investigar ainda mais a seletividade do WA para a inibição de PHGDH, os autores geraram um modelo de xenoenxerto usando células HCT116 knockout para PHGDH (KO). Neste modelo, a ausência de PHGDH inibiu marcadamente a proliferação de células HCT-116 (consulte a Figura 7, AC). Além disso, a expressão de Ki67, um marcador de proliferação celular, foi significativamente reduzida no modelo de xenoenxerto de células PHGDH KO HCT116 (consulte a Figura 7, D).
Notavelmente, no modelo de xenoenxerto utilizando células PHGDH KO HCT-116, WA não demonstrou efeito inibitório significativo na proliferação celular (consulte a Figura 7, EG), confirmando ainda que o efeito inibitório de WA em células HCT-116 dependia de PHGDH.
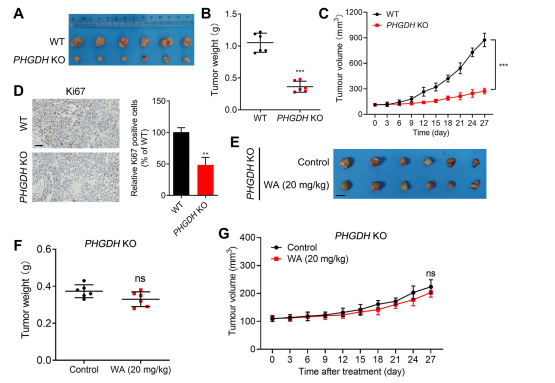
Figura 7: Efeito do WA na proliferação de células PHGDH KO HCT-116 in vivo
Os resultados deste estudo não apenas fornecem pistas importantes para o futuro desenvolvimento de medicamentos anticâncer para PHGDH, mas também trazem uma nova esperança e potencial para o desenvolvimento de novos medicamentos no campo da terapia do câncer.
Referência:https://doi.org/10.1016/j.apsb.2021.06.008

