Анализ ABPP выявил новый противовоспалительный механизм итаконовой кислоты посредством белок-метаболитных взаимодействий
Роль итаконата, эндогенного метаболита, имеющего решающее значение для воспаления и иммунной регуляции, раскрыта в совместной статье команды ChomiX Biotech. В исследовании новаторски использовалась технология ABPP, чтобы показать, что итаконат модифицирует S-гликозилирование остатков цистеина на ключевых гликолитических ферментах, тем самым влияя на клеточный метаболизм. Исследователи составили карту взаимодействий белок-итаконат и обнаружили, что итаконат напрямую связывает и регулирует множество ферментов на пути гликолиза, влияя на его скорость и направление. Это исследование расширяет наши знания о механизмах метаболического контроля во время воспаления, связанного с заболеванием, и демонстрирует силу ABPP в изучении того, как небольшие молекулы модулируют функции белка. Являясь лидером в области химической протеомики, Corolus BioScience предлагает комплексные решения, включая разработку зондов, обработку образцов, высокопроизводительный скрининг и анализ данных, чтобы помочь клиентам раскрыть схожие механизмы метаболической регуляции.
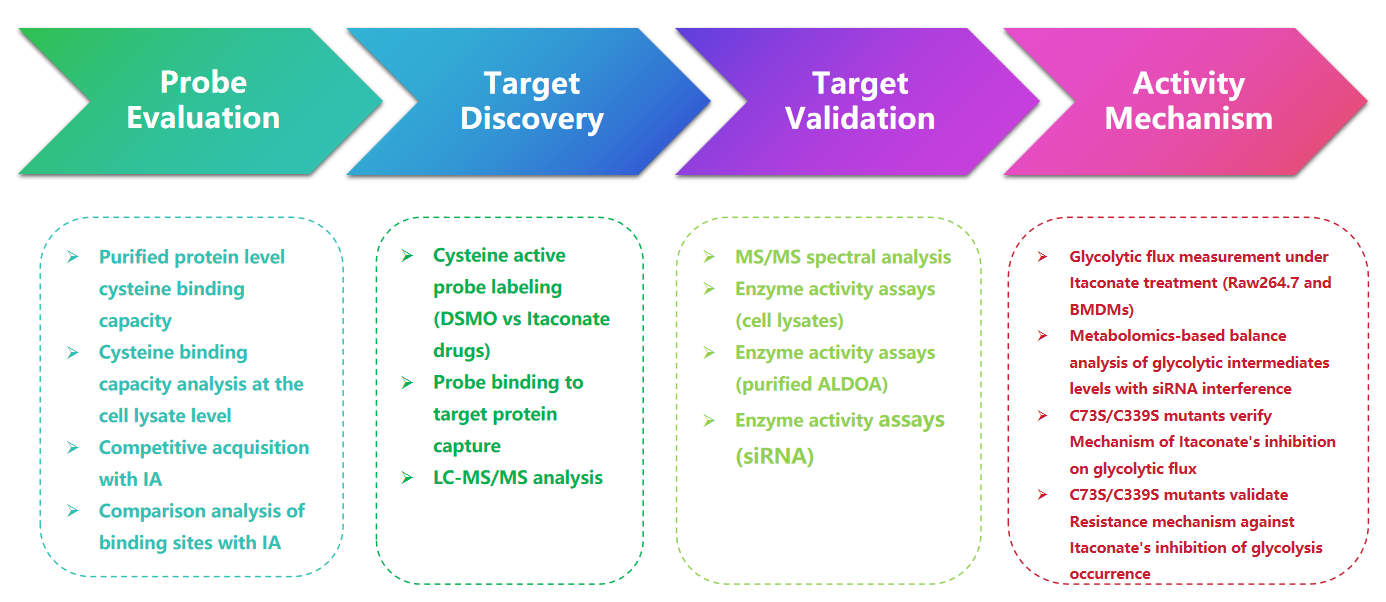
1. Обнаружение модификаций итаконата с помощью зонда 1-OH-Az
В этом исследовании авторы использовали передовые методы профилирования для исследования остатков цистеина, нацеленных на итаконат. Первоначально они оценили зонд 1-OH-Az с помощью гель-электрофореза и провели конкурентные эксперименты с использованием IA-алкина. Масс-спектрометрическая проверка подтвердила, что 1-OH-Az избирательно метит участки цистеина, при этом 87% вновь идентифицированных белков ранее не были документированы как лиганд-связывающие белки в DrugBank. Учитывая разнообразные функции и значимость этих белков для лечения заболеваний, зонд 1-OH-Az можно использовать для идентификации активных цистеинов как потенциальных мишеней для новых терапевтических средств.
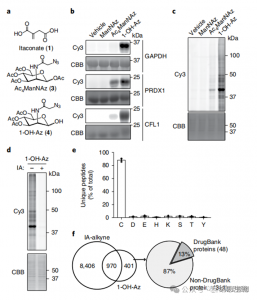
Рисунок 1. 1-OH-Az как эффективный и уникальный зонд для анализа цистеина для обнаружения модификаций итаконата.
2. Идентификация сайтов модификации итаконата с использованием методов количественной протеомики
Исследователи провели эксперименты isoTOP-ABPP для количественного определения остатков цистеина, модифицированных итаконатом, с использованием зонда 1-OH-Az. После предварительной обработки лизата была использована количественная протеомика с изотопно-меченным линкером для анализа воздействия различных концентраций итаконата, определяя его конкретные цели. Сравнительные эксперименты были также проведены с использованием двух концентраций IA-алкина, который, хотя и проявлял более широкую активность и охват, распознавал только 65 и 50 эффективных конкурирующих сайтов. Примечательно, что 1-OH-Az продемонстрировал значительно более высокое конкурентное преимущество среди совместно определяемых цистеинов.
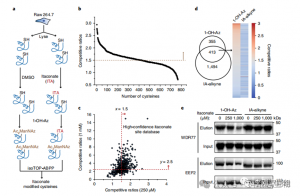
Рисунок 2: Химический протеомный анализ модифицированных итаконатом цистеинов с использованием конкурентного изоТОП-ABPP с 1-OH-Az.
3. Итаконат модифицирует и ингибирует ключевой гликолитический фермент.
Масс-спектрометрический анализ показал, что итаконат модифицирует три ключевых гликолитических фермента: ALDOA, GAPDH и LDHA. Эндогенная итаконатная модификация Cys73 и Cys339 ALDOA была подтверждена в стимулированных LPS клетках Raw264.7. Из-за их близости авторы предположили, что такие модификации могут влиять на активность альдолазы. Действительно, обработка 1 мМ итаконатом приводила к снижению активности фермента ALDOA, не влияя на экспрессию белка. Кроме того, анализ isoTOP-ABPP показал, что Cys84 на LDHA и Cys245 на GAPDH также являются мишенями для модификации итаконата.

Рисунок 3. Итаконат может изменять и ухудшать функцию ALDOA.
4. Итаконат в основном подавляет гликолиз, воздействуя на ALDOA.
Чтобы оценить регуляторную роль ITAC в воспалительном гликолизе макрофагов, авторы отслеживали потребление глюкозы и выработку лактата в клетках Raw264.7 до и после стимуляции LPS, демонстрируя, что ITAC значительно снижает оба показателя, что указывает на подавление гликолитической функции. Чтобы подтвердить влияние ITAC на ALDOA и последующее ингибирование гликолиза, они нейтрализовали эндогенную ALDOA с помощью RNAi и сверхэкспрессировали либо WT, либо двойную мутантную (C73S/C339S) ALDOA в клетках Raw264.7. Как и ожидалось, нокдаун ALDOA привел к снижению потребления глюкозы и выработки лактата, что сделало клетки нечувствительными к лечению ITAC. Повторное введение WT или мутантной ALDOA восстанавливало метаболические уровни в необработанных клетках; однако клетки, сверхэкспрессирующие мутантную ALDOA, проявляли пониженную чувствительность к гликолитическому ингибированию по сравнению с WT. Ферментативные анализы активности альдолазы соответствуют гликолитическим состояниям.
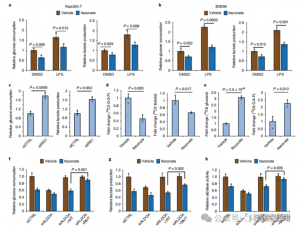
Рисунок 4. Итаконат изменяет гликолитический путь путем модификации ALDOA.
5. Ингибирование ALDOA способствует противовоспалительному ответу.
Эти результаты показали, что ITAC подавляет активность гликолитического пути путем модификации остатков цистеина Cys73 и Cys339 на ALDOA. На основании известного противовоспалительного действия диметилфумарата за счет модификации цистеина ГАФД и гликолитического ингибирования авторы также пришли к выводу, что ITAC может аналогичным образом вмешиваться в гликолиз и оказывать противовоспалительное действие. Нокдаун ALDOA значительно снижает секрецию IL-1β при стимуляции ЛПС, что позволяет предположить его участие в регуляции воспаления посредством гликолиза. Частичное устранение противовоспалительных эффектов нокдауна ALDOA добавлением пирувата указывает на ограниченную роль LDHA в воспалительных реакциях.
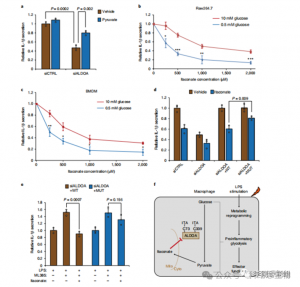
Рисунок 5. Противовоспалительное действие итаконата опосредовано ингибированием ALDOA, что приводит к нарушению гликолиза.
Таким образом, в этой статье эффективно использовались технологии профилирования цистеина на основе S-гликозилирования и методологии ABPP для построения сети взаимодействий между итаконатом и родственными белками. Оно убедительно демонстрирует, что итаконат служит важнейшим регулятором метаболизма, специфически модифицируя остатки цистеина в белках для контроля гликолитического пути. Это исследование не только проясняет механизм действия итаконата как нового метаболического регулятора, но также предоставляет убедительные доказательства того, как небольшие метаболиты взаимодействуют с белками, модулируя основные метаболические пути.
Помимо ABPP, другие методы изучения взаимодействий между низкомолекулярными метаболитами и белками включают, помимо прочего:
1. Расширение сродства (вытягивание вниз)методы, при которых нативное соединение преобразуется в биотинилированный зонд, который инкубируется с клеточными лизатами с последующим обогащением, опосредованным стрептавидином, и выделением белковых мишеней, которые связываются с биотиновым зондом.
2.Масс-спектрометрия ограниченного протеолиза (LiP-MS)— это технология обнаружения целей, основанная на сродстве к белкам. Когда определенные лиганды, такие как лекарства или небольшие молекулы, связываются с определенными белками, они вызывают конформационные изменения или стерические препятствия, приводящие к дифференциальным сайтам расщепления по сравнению с несвязанным белком. Обнаружив эти различия с помощью масс-спектрометрии, этот метод может выявить взаимодействия лекарства с белком внутри клеток и определить молекулярные мишени препарата.
3.Анализ клеточного термического сдвига (CETSA)Первоначально был разработан для помощи в исследованиях мишени противораковых лекарств и является одним из первых широко используемых безметочных методов для изучения взаимодействия лекарств с мишенями в интактных клетках. CETSA в первую очередь опирается на принцип, согласно которому при связывании с целевым белком соединение повышает его термическую стабильность. После инкубации образцов с соединением и соответствующими контролями при различных градиентах температуры белки, связанные с лигандом, остаются свернутыми и относительно стабильными после нагревания, тогда как несвязанные белки разворачиваются и осаждаются из-за денатурации. Последующий анализ термостабильности растворимых белков с помощью методов иммуноблоттинга или масс-спектрометрии на основе их кривых плавления подтверждает взаимодействие между соединением и внутриклеточными белками.
4. Аффинная хроматографиявключает конъюгацию целевого метаболита с твердофазной матрицей для захвата белковых комплексов, которые с ним взаимодействуют. Захваченные белки затем идентифицируются с использованием таких методов, как масс-спектрометрия.
5.Поверхностный плазмонный резонанс (ППР)используется для измерения в режиме реального времени без меток кинетических параметров, связанных с взаимодействием между небольшими молекулами и белками.
6. Кристаллография белковобъясняет трехмерные структуры белков, образующих комплексы с небольшими молекулами-лигандами, обеспечивая интуитивное понимание мест связывания и механизмов действия. Решая эти структуры, исследователи могут напрямую визуализировать, как небольшие молекулы взаимодействуют со своими белковыми мишенями.

