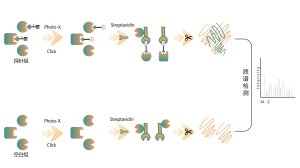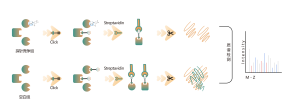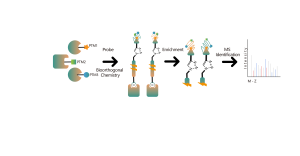Продукты
Хемопротеомическое профилирование белковых мишеней нековалентных низкомолекулярных препаратов
Технические характеристики платформы
Маломолекулярные препараты играют важную роль в области исследований и разработок лекарственных средств. Текущие одобренные FDA лекарства нацелены в общей сложности на 812 различных белков человека. Среди препаратов, направленных против вышеупомянутых мишеней, 84% составляют низкомолекулярные препараты. Более того, только 639 из этих белков подверглись воздействию низкомолекулярных лекарств. Взаимодействие между низкомолекулярным лекарственным средством и белком-мишенью включает нековалентный и ковалентный режимы, причем первый в настоящее время является доминирующим.
Нековалентные взаимодействия, такие как водородные связи и π-π-укладка, могут быть нарушены из-за денатурации белка. Чтобы решить эту проблему, наша платформа использует фотоаффинную маркировку — хорошо зарекомендовавший себя метод точного прикрепления «химических меток» к активному сайту белка. Кроме того, наша инновационная стратегия химического сшивания in situ преобразует временные нековалентные взаимодействия белков в ковалентные и постоянные химические связи. Используя химический зонд, который функционализирован как фотоаффинными, так и биоортогональными фрагментами, платформа хемопротеомики ChomiX продемонстрировала свою эффективность в успешном вылове белковых мишеней в клеточных лизатах, тканях и живых клетках. Спектр биоактивных низкомолекулярных препаратов, применяемых на платформе, включает множество соединений, включая эндогенные метаболиты, натуральные продукты и нековалентные синтетические молекулы.

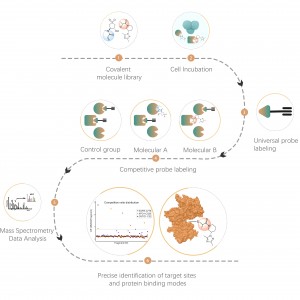
Рабочий процесс

Платформа следует структурированному рабочему процессу, начиная с маркировки живых клеток с помощью фотоаффинного зонда, полученного из нековалентных молекул. Последующие этапы включают извлечение меченых протеомов, биоортогональное лигирование, обогащение на основе стрептавидина, протеазное расщепление, изотопное мечение и, наконец, масс-спектрометрическое обнаружение.
Тематическое исследование
Цель проекта
Соединение А показало хорошую антипролиферационную активность в анализе жизнеспособности клеток. Платформу химиопротеомики использовали для характеристики белков-мишеней.
Экспериментальный метод
Фотоаффинный химический зонд Probe A был разработан и синтезирован на основе данных SAR соединения A. Зонд A также продемонстрировал аналогичную антипролиферационную активность в линии опухолевых клеток. Были проведены эксперименты на основе геля и МС. Данные МС анализировали для выявления МОА.
Визуализация данных

Результаты флуоресценции на основе геля показали, что зонд А может эффективно метить белки, и сигнал мечения может в значительной степени конкурировать со стороны соединения А. В совокупности эти данные показали, что зонд А можно использовать в качестве химического зонда для последующего обнаружения мишени, поскольку он может связывать те же белки, что и соединение А.



График вулкана показал, что 114 белков (выделено красным) были значительно обогащены зондом A в группе зонда A по сравнению с группой ДМСО (прямой), а 38 белков (выделено красным) значительно конкурировали с соединением A в группе зонда A по сравнению с (A+зондом A). ) (Конкурсная) группа. Диаграммы Венна показали, что 32 перекрывающихся белка могут с высокой степенью уверенности быть потенциальными мишенями для связывания соединений А.(n = 3, соотношение ≥2,p-значение ≤ 0,05)