Использование химической протеомики для идентификации функциональной мишени SLC25A20 мебутата ингенола при актиническом кератозе
В этом исследовании используется химическая протеомика, чтобы раскрыть новую мишень макроморола метилбутилата (Ing-Meb), препарата, используемого для лечения солнечного кератоза. Первоначально исследовательская группа разработала и синтезировала фотоаффинный зонд Ing-Meb под названием Ing-Dayne, который образует ковалентные связи с целевыми белками при воздействии ультрафиолетового света, что облегчает идентификацию потенциальных функциональных мишеней. Путем последующей проверки авторы определили SLC25A20 как основную мишень Ing-Meb. SLC25A20 представляет собой митохондриальную мембраносвязанную карнитин-ацилкарнитинтранслоказу, участвующую в метаболизме жирных кислот. Примечательно, что ингибирующее действие Ing-Meb на функцию SLC25A20 приводит к усиленному накоплению длинноцепочечных ацилкарнитинов, что подтверждает, что Ing-Meb оказывает свои терапевтические эффекты путем модуляции пути окисления жирных кислот. Кроме того, исследование углубляется в значение структурных модификаций в исследованиях натуральных продуктов. Синтезировав фотоаффинный зонд Инг-Дейна посредством структурной модификации Ing-Meb, исследователи успешно обнаружили новую мишень, отличную от традиционного понимания. Это не только расширяет понимание Ing-Meb и способа его действия, но также подчеркивает ключевую роль структурных модификаций в исследованиях химической протеомики для раскрытия сложностей натуральных продуктов. Такие идеи способствуют дальнейшему развитию инноваций в области лекарств, включая оптимизацию эффективности существующих лекарств, разработку новых методов лечения, нацеленных на конкретные заболевания, и выяснение механизмов побочных эффектов лекарств.
Маршрут исследования
Экспериментальный процесс
1. Разработка синтетического фотоаффинного зонда Ing-Dayne раскрывает механизм, лежащий в основе связывания препарата Ing-Meb от актинического кератоза с его белком-мишенью.
В этом исследовании использовался инг-аффинный зонд Ing-Dayne, полученный на основе терапевтического препарата для лечения актинического кератоза Ing-Meb (см. Рисунок 1). Благодаря совместному культивированию этой молекулы-зонда со специфическими клетками и последующему облучению УФ-светом двойная акридиновая структура внутри зонда образовала стабильные ковалентные связи с внутриклеточными белками. При лизисе клеток химическая реакция Click способствовала присоединению азида-тетраметилродамина репортерной группы к целевому белку (как показано на рисунке 2). Последующий анализ SDS-PAGE (изображенный на рисунке 3) показал, что Ing-Meb проявляет значительный эффект конкурентного связывания с зондом, тогда как Ingenol, обладающий аналогичной структурой, не демонстрирует конкурентного ингибирования.
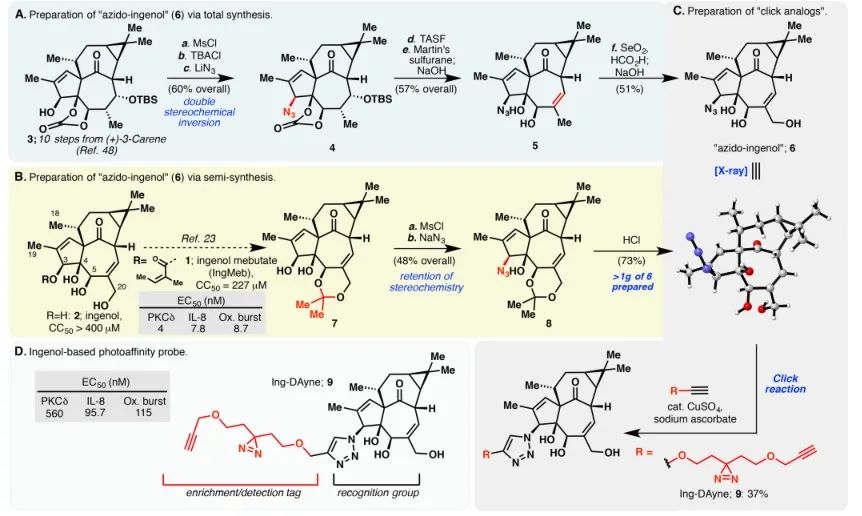
Рисунок 1: Иллюстрирует два синтетических пути, использованных для синтеза Инг-Дейна.
2. Новый зонд 11b идентифицировал 44 связанных с воспалением целевых белка BBR в клетках THP-1 и выявил EIF2AK2, eEF1A1, PRDX3 и VPS4B как прямые мишени, специфически взаимодействующие с BBR.
Авторы в серии экспериментов успешно применили новый зонд 11b для маркировки и очистки потенциальных белков-мишеней в клетках THP-1. После этого они использовали анализ LC-MS/MS для идентификации 44 белков, связанных с воспалением, с молекулярной массой от 20 до 80 кДа, среди которых было обнаружено, что шесть потенциально играют решающую роль в противовоспалительном действии BBR. В дальнейших исследованиях было подтверждено, что EIF2AK2, eEF1A1, PRDX3 и VPS4B являются прямыми мишенями BBR, демонстрируя эффекты конкурентного ингибирования при высоких концентрациях обработки BBR. Это открытие раскрыло вероятное существование специфических взаимодействий между этими белками и BBR, тем самым проливая новое понимание их взаимодействия с препаратом во время его противовоспалительных процессов.
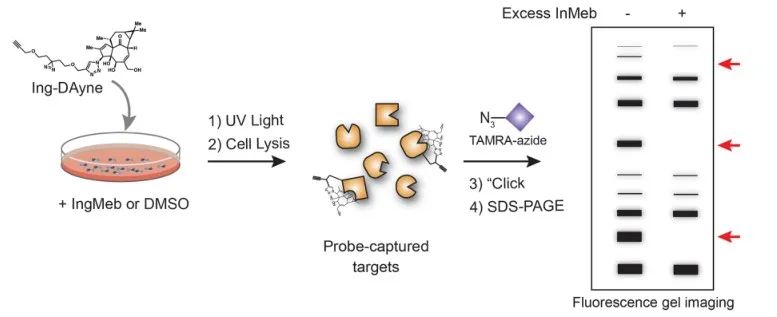
Рисунок 2: Процесс проверки цели Ing-Dayne на основе геля.
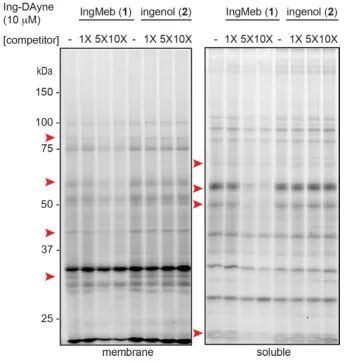
Рисунок 3: Конкурентное ингибирование Ing-Meb и ингенола на молекуле-зонде Ing-Dayne.
3. Скрининг SILAC в сочетании с вестерн-блоттингом выявил SLC25A20 в качестве основной мишени препарата класса Ингенол Ing-Meb.
Первоначально авторы исследовали 28 потенциальных белков-мишеней, используя технологию мечения стабильных изотопов аминокислотами в клеточной культуре (SILAC) (рис. 4). Впоследствии, посредством дальнейших экспериментов по скринингу и вестерн-блоттингу (рис. 5), исследователи заметили, что Ing-Meb проявляет самый сильный ингибирующий эффект на SLC25A20 среди этих потенциальных мишеней, что убедительно свидетельствует о том, что SLC25A20 является одной из основных функциональных мишеней Ing-Meb.
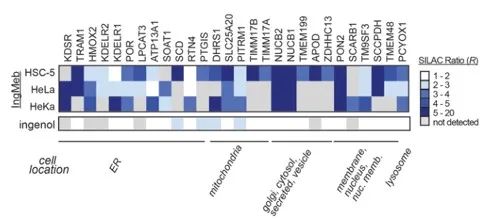
Рисунок 4: 28 потенциальных целей, полученных в результате первоначального скрининга.
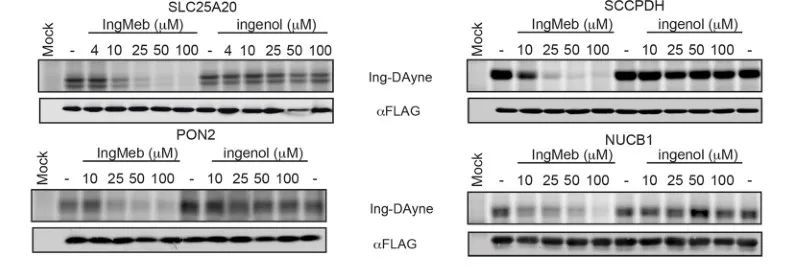
Рисунок 5: Вестерн-блоттинг четырех потенциальных белков-мишеней.
4. Ing-Meb регулирует путь окисления жирных кислот путем ингибирования SLC25A20, белка митохондриальной мембраны, также известного как ботулиническая алкалипоилтрансфераза, тем самым раскрывая свою мишень как лекарство от актинического кератоза.
Авторы исследовали SLC25A20, также известную как ботулиническая щелочная липоилтрансфераза или CACT, мультимодальный интегральный мембранный белок, локализованный внутри митохондриальной мембраны. Его основная функция заключается в транспортировке длинноцепочечных ацилкарнитинов в митохондрии, способствуя их обмену со свободным карнитином. Эти транспортированные ацилкарнитины впоследствии превращаются в жирный ацилКоА под действием карнитинпальмитоилтрансферазы-2 (CPT-2), служа, таким образом, предшественниками β-окисления жирных кислот. Экспериментальные результаты выявили значительное увеличение клеточного содержания длинноцепочечного ацилкарнитина при возрастающей концентрации препарата Ing-Meb от актинического кератоза (показано на рисунке 6). Это наблюдение убедительно подтверждает ингибирующее действие Ing-Meb на SLC25A20, тем самым подтверждая, что SLC25A20 является одной из основных мишеней, опосредующих действие Ing-Meb.
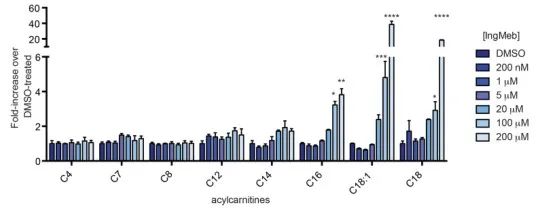
Рисунок 6: Влияние Ing-Meb на длинноцепочечные ацилкарнитины.
5. Косвенное подтверждение цитотоксического действия Ing-Meb посредством экспрессии SLC25A20: выявление его целевой функции в регуляции активности лекарственного средства.
Исследователи стремились напрямую связать ингибирование SLC25A20 в клетках HeLa с потенциальными цитотоксическими эффектами Ing-Meb. Результаты показали, что, хотя сверхэкспрессия SLC25A20 не изменяла половину ингибирующей концентрации Ing-Meb в этих клетках, примечательно, что увеличение экспрессии SLC25A20 значительно смягчало влияние Ing-Meb на накопление длинноцепочечного ацилкарнитина (изображено на рисунке 7). . Этот результат дополнительно подтверждает гипотезу о том, что SLC25A20 служит основной функциональной мишенью для лекарственной активности Ing-Meb.
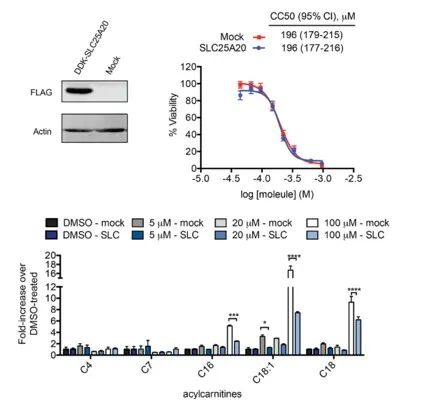
Рисунок 7: Влияние экспрессии или отсутствия SLC25A20 на CC50 и ацилкарнитин.
Это исследование не только раскрывает новые цели Ing-Meb, но также обеспечивает новую теоретическую основу и стратегическое направление для целевого открытия структурно сложных натуральных продуктов. Ссылка:

