Техническая информация
Химическая протеомная технология становится маяком перемен, направляя разработку лекарств от очищенных белков к сфере живых клеток.
Химическая протеомная технология служит надежной платформой для открытия лекарств, характеризующейся исследованием взаимодействий малых молекул с белками внутри живых клеток. Одна из наших платформ для разработки ковалентных лекарств предназначена для обнаружения ковалентных связующих, которые взаимодействуют с белками-мишенями посредством ковалентных реакций с тиоловой группой остатков цистеина. В отличие от традиционных стратегий скрининга одной цели, платформа химической протеомики позволяет проводить количественный анализ взаимодействий между электрофильными фрагментами и почти всеми белками в живых клетках с разрешением по аминокислотным остаткам. Он может похвастаться охватом более 10 000 белков и~40 000 сайтов цистеина (потенциальные сайты связывания лекарств) из нескольких клеточных линий млекопитающих.

Рабочий процесс
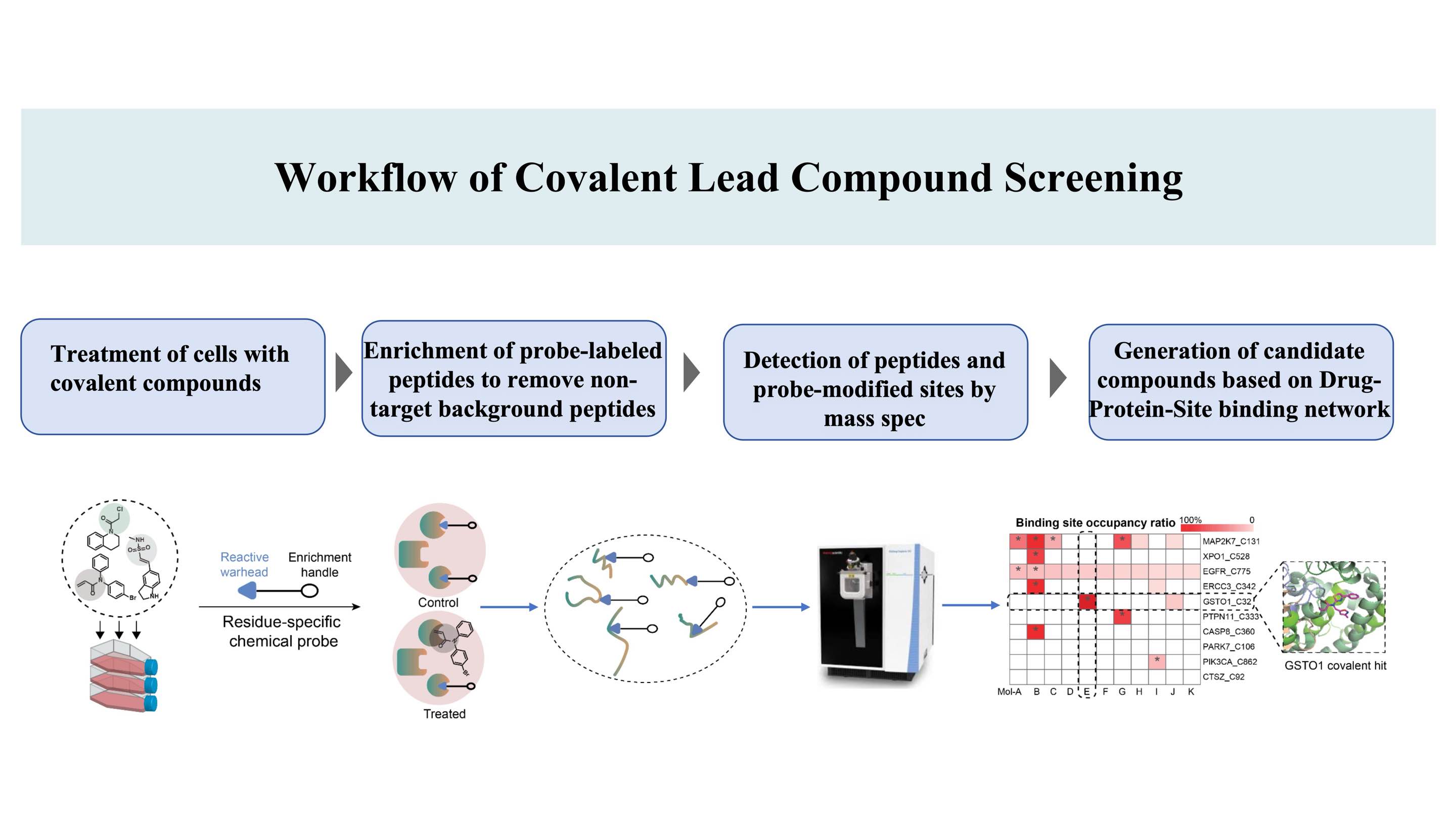
Рабочий процесс обнаружения ковалентных соединений, нацеленных на сайты связывания* на белках, основан на патенте DIA-ABPP (профилирование белков на основе данных, основанное на сборе данных) (сайт ковалентного связывания — это аминокислота, которую можно пометить химическими зондами, тем самым обеспечивая лигируемость)
Технические преимущества
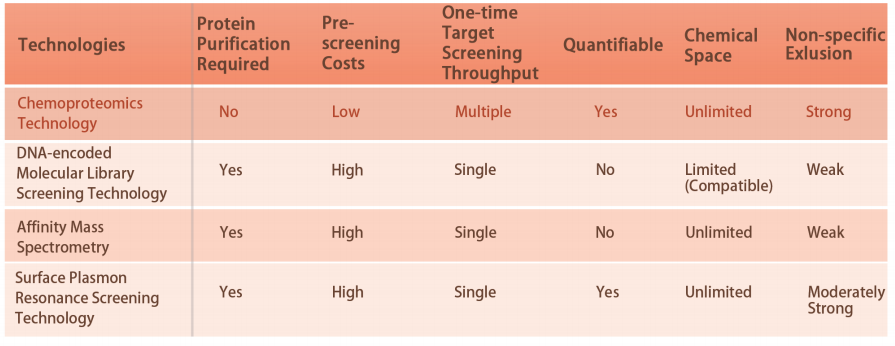
Особенность 1
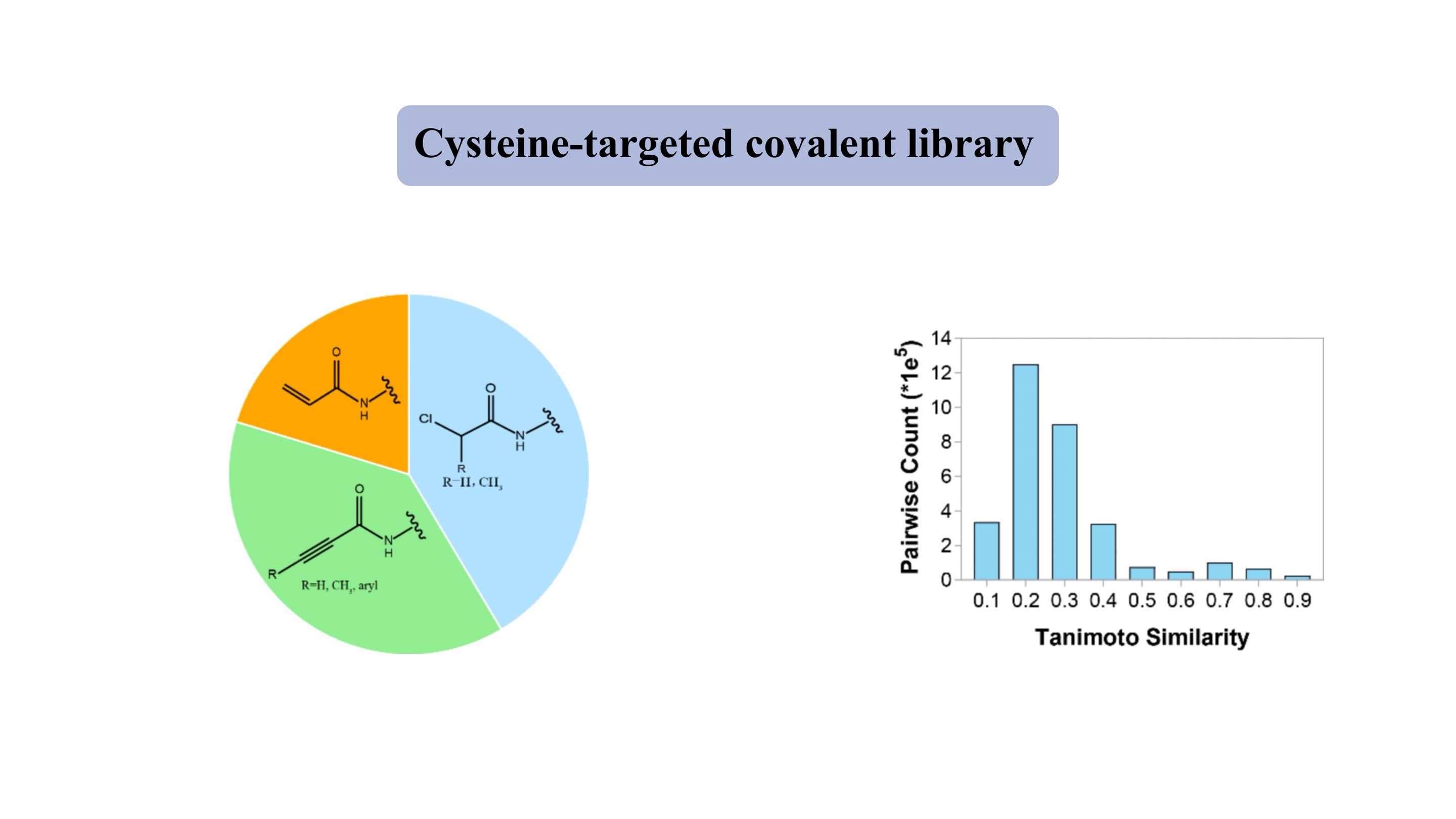
Ковалентная библиотека, нацеленная на цистеин
Ковалентная библиотека, нацеленная на цистеин, содержит типичные мягкие электрофильные «боеголовки», такие как акриламиды и хлорацетамиды. «Лекарственно-подобная» библиотека содержит ~3000 соединений, более 80% из которых имеют молекулярную массу 300-500 Да. Для большинства соединений индекс сходства Танимото составляет около 0,3 для каждых двух членов, что указывает на высокую степень разнообразия.
Особенность 2
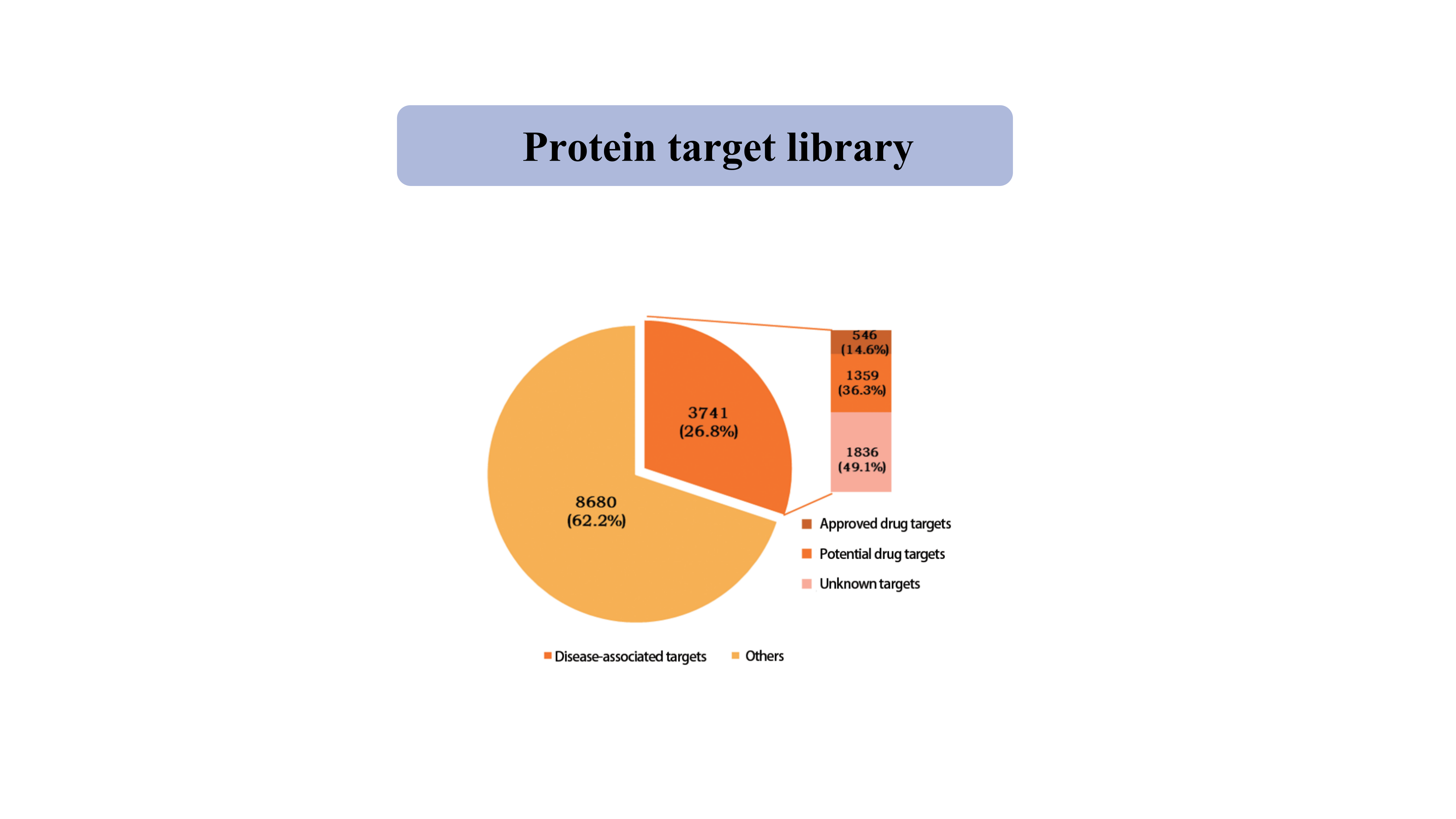
Белковая мишеньбиблиотека
В настоящее время библиотека белков-мишеней, захватываемых тиол-специфичным химическим зондом, охватывает 39962 сайта цистеина из 12421 белка, включая киназу, фосфатазу, лигазы и факторы транскрипции.
Тематическое исследование
DCAF1 служит субстратным рецептором для двух различных лигаз E3 (CRL4DCAF1 и EDVP), играя критическую физиологическую роль в деградации белка. Несколько ковалентных и нековалентных связующих, нацеленных на домен WDR DCAF1, были разработаны для поддержки целенаправленной деградации белков (Направленная деградация белка с помощью электрофильных PROTAC, которые стереоселективно и сайт-специфично взаимодействуют с DCAF1. J. Am. Chem. Soc. 2022, 144, 40, 18688). –18699 PROTAC на основе DCAF1 с активностью против клинически подтвержденных мишеней. преодоление внутреннего и приобретенного деградирующего сопротивления. Прим. 2024, 15, 275).
Мы впервые обнаружили, что Mol-380 ковалентно взаимодействует с DCAF1_C69, подчеркивая его как потенциальный сайт, пригодный для применения лекарств, для приложений TPD, отдельно от домена WDR. Наши результаты подчеркивают значительную ценность автоматизированной химико-протеомной платформы ChomiX в обнаружении новых лигандов для не поддающихся лечению мишеней в живых клетках, включая транскрипционные факторы и мембранные белки, подчеркивая ее потенциальное влияние на разработку лекарств и функциональные исследования.
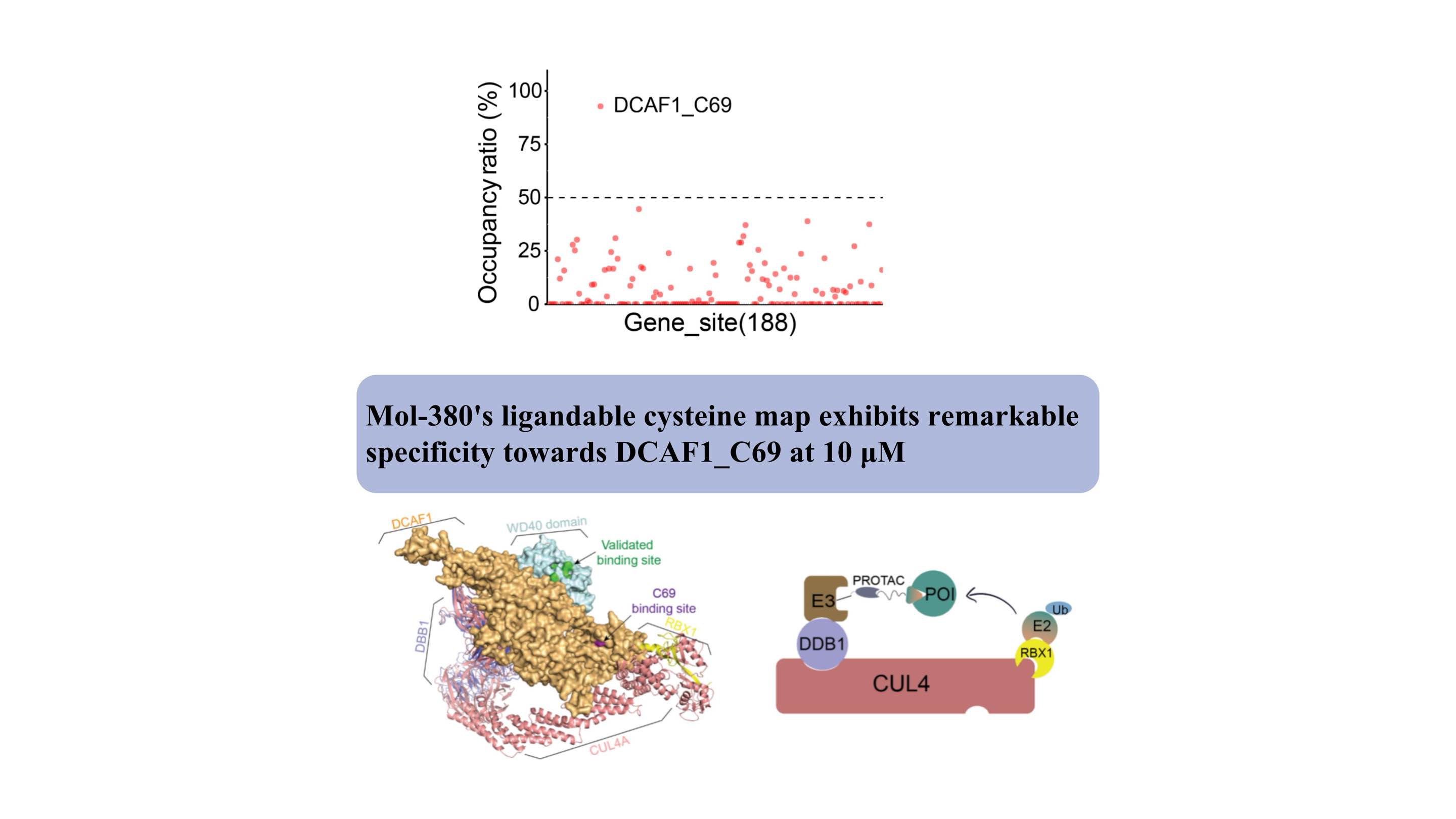
Структурно сайт связывания C69 расположен рядом с проверенным карманом домена WD40, как показано в комплексной модели, что предлагает новый сайт для разработки PROTAC.

