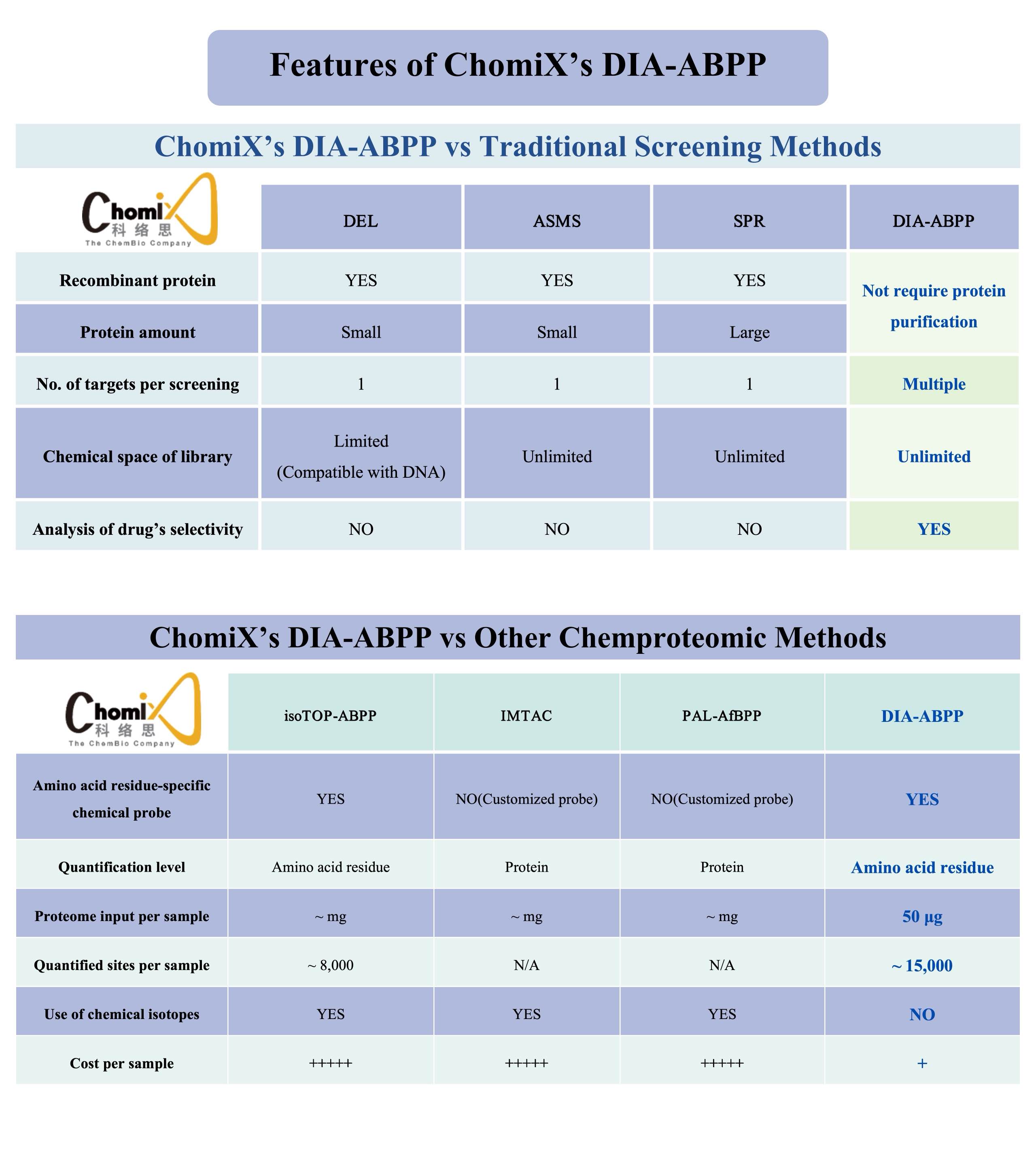
Наша научная платформа,Экран ChomiX, основанный на DIA-ABPP (профилирование белков на основе независимого сбора данных и активности), является важной частью нашей передовой методологии ABPP. Через нашуЭкран ChomiXтехнологическую платформу, мы можем проверять ковалентные соединения свинца на наличие не поддающихся лечению мишеней. Конкретный процесс включает в себя ковалентную молекулярную обработку живых клеток, разделение и обогащение меченных химическими зондами пептидов, масс-спектрометрическое обнаружение высокого разрешения и построение сети связывания лекарственного средства с сайтом-мишенью. Это позволяет нам оценивать способность связывания и селективность лекарств в отношении определенных карманов аминокислотных остатков на нескольких белках-мишенях одновременно, создавая соединения-кандидаты. В настоящее время мы создали комплексную библиотеку белков-мишеней, включая крупнейшую отечественную библиотеку ковалентных соединений, нацеленных на цистеин. , основанный на нашей библиотеке химических зондов и других характерных основных модулях.
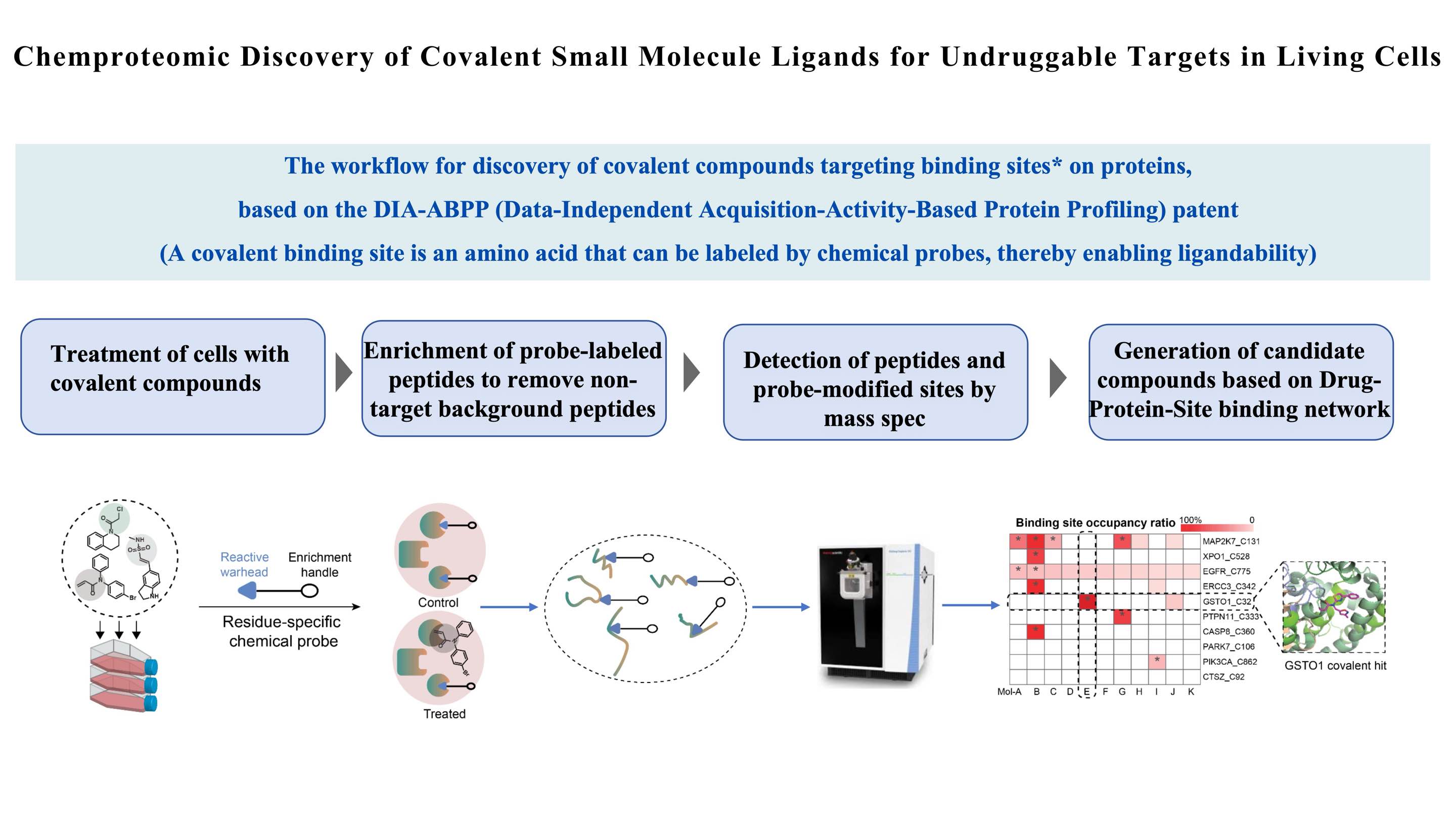
Степень занятости сайта связывания (сайта Protein_Cys) для каждого соединения определяют с использованием интенсивностей масс-спектра количественно определенных пептидов, меченных зондом. По сути, цистеин-специфичный зонд конкурирует с соединениями за связывание с определенным карманом связывания. Чем ниже сигнал пептида, меченного зондом, тем сильнее способность соединения к заполнению. Для каждого цистеинового участка интересующего белка (POI) проводят определение дозозависимых коэффициентов вовлечения мишени (TE50) для выбранных соединений. Затем кандидаты на попадание подтверждаются посредством ранжирования их значений TE50. Чем ниже TE50, тем сильнее соединение занимает цистеиновый участок POI в живых клетках.