
Продукты
Хемопротеомическое открытие новых свинцовых структур для неизлечимых мишеней
Техническая информация
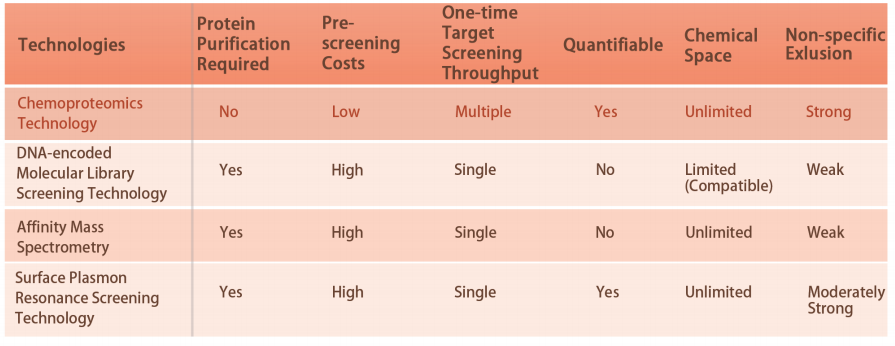
В настоящее время только около 800 белков подвергаются воздействию одобренных FDA лекарств, а большое количество мишеней, связанных с болезнями, «не поддаются лечению». Потому что в настоящее время большинство технологий основаны на очищенных белках. Появление химпротеомики произвело революцию в открытии лекарств от очищенных белков до живых клеток. Он способен количественно анализировать взаимодействия между небольшими молекулами и белками в масштабе протеома человека. Теперь открытие ковалентных структур против определенных аминокислотных остатков белков-мишеней, таких как цистеин, лизин, метионин и тирозин, было продемонстрировано в клеточных лизатах и живых клетках. ChomiX будет использовать собственную платформу химиопротеомики, чтобы быстро преодолеть барьеры «непреодолимых» целей.

Технические преимущества
Технические характеристики платформы
Платформа DIA-ABPP предназначена для обнаружения ковалентных связующих, которые взаимодействуют с белками-мишенями посредством ковалентных реакций с тиоловой группой остатков цистеина. Как только активные цистеиновые остатки белков будут преимущественно заняты ковалентными молекулами, будет конкурировать метка универсального зонда, специфически реагирующего с тиоловой группой. В сочетании с методами количественной протеомики, основанными на DIA, можно количественно оценить интенсивность меченных зондом пептидов между ковалентной молекулой и контрольной группой. Эти различия сигналов представляют собой степень заполнения ковалентных молекул относительно их связывающих белков. В отличие от традиционных стратегий скрининга одной цели, платформа DIA-ABPP позволяет проводить количественный анализ взаимодействий между фрагментными электрофилами и почти всеми белками в живых клетках с разрешением по аминокислотному остатку, что значительно повышает эффективность и снижает риск для проекта по открытию высокопроизводительных ведущих структур. .

Рабочий процесс скрининга соединений ковалентного свинца
Особенность 1

Наша библиотека молекул, подобных лекарствам, содержит множество реактивных групп (боеголовок), характеризующихся умеренной электрофильной реакционной способностью, таких как акриламид, хлорацетамид и алкинамид. Эти молекулы имеют структурно разнообразные фармакофоры, которые соответствуют правилу пяти Липински.
Особенность 2

В настоящее время библиотека белков-мишеней, захватываемых тиол-специфичным химическим зондом, охватывает 39962 сайта цистеина из 12421 белка, включая киназу, фосфатазу, лигазы и факторы транскрипции. Библиотека постоянно обновляется, обеспечивая доступ к самой последней информации о конкретных объектах и объектах. Подробную информацию о конкретных целях и объектах можно получить по ссылке ниже.
Функция 3

В ходе одного скринингового эксперимента платформа способна количественно оценить целевое взаимодействие малых молекул (A2-H6) со всеми мечеными белками во всем протеоме. На рисунке выше показано заселение выбранных клинически важных мишеней ковалентными молекулами. Чем темнее цвет, тем выше заселенность молекулами карманов связывания, включая ортостерические и аллостерические сайты (звездочка указывает, что степень заполнения превышает 80%). Таким образом, сродство и селективность каждой молекулы можно оценить одновременно для последующей оптимизации структуры.




