[Финансирование национального ключевого проекта] Раскрытие металлосвязывающих белков: прорывы METAL-TPP и инновации в области открытия лекарств
Металлсвязывающие белки являются важнейшими компонентами, которые образуют стабильные комплексы с ионами металлов, выполняя различные жизненно важные функции в живых организмах, включая передачу сигналов клеткам, катализ биохимических реакций и поддержание гомеостаза ионов металлов. Их нарушение регуляции связано с такими заболеваниями, как рак, неврологические расстройства и метаболические заболевания. Понимание их роли в патогенезе заболеваний имеет решающее значение для диагностики и лечения. Более того, металлсвязывающие белки являются важной мишенью при разработке лекарств, поскольку многие лекарства взаимодействуют с ними, оказывая терапевтический эффект. В этом исследовании исследователи представили METAL-TPP, современный метод химической протеомики. Сочетая термостабильный количественный протеомный анализ (TPP) с идентификацией металлсвязывающих белков, METAL-TPP обеспечивает эффективное и точное обнаружение металлсвязывающих белков. Примечательно, что он регулирует термостабильность белков с помощью ряда хелаторов металлов, облегчая точную идентификацию чистых белков и клеточных лизатов. Этот инновационный подход предлагает новое понимание функций и механизмов металлосвязывающих белков, помогая биологическим исследованиям, пониманию болезней и разработке лекарств. Keloxi Biology предоставляет передовые ABPP, TPP и другие технические услуги в области фармацевтических исследований и разработок, поддерживая исследователей в изучении механизмов действия лекарств и продвижении процессов разработки новых лекарств.

Экспериментальный процесс
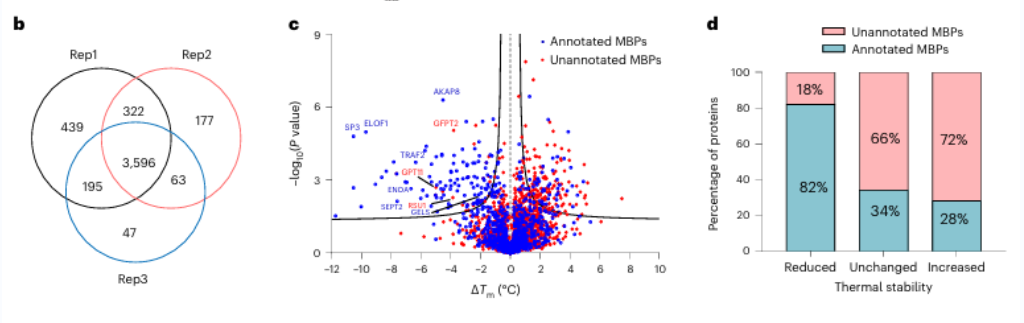
1. Семнадцать потенциальных металлсвязывающих белков были идентифицированы с помощью METAL-TPP.
Первоначально исследователи оценили эффективность хелатирования металлов широкого спектра действия с использованием ЭДТА на чистых белках и клеточных лизатах. Они заметили, что METAL-TPP эффективно обнаруживает снижение термической стабильности металлсвязывающих белков. Впоследствии был проведен систематический анализ белков человеческого происхождения с использованием METAL-TPP, в результате которого было выявлено 125 белков, демонстрирующих пониженную термостабильность. Среди них 102 ранее были известны металлсвязывающими белками. Кроме того, были обнаружены 17 потенциальных металлсвязывающих белков без предварительной функциональной аннотации, что дает новое понимание роли металлсвязывающих белков.
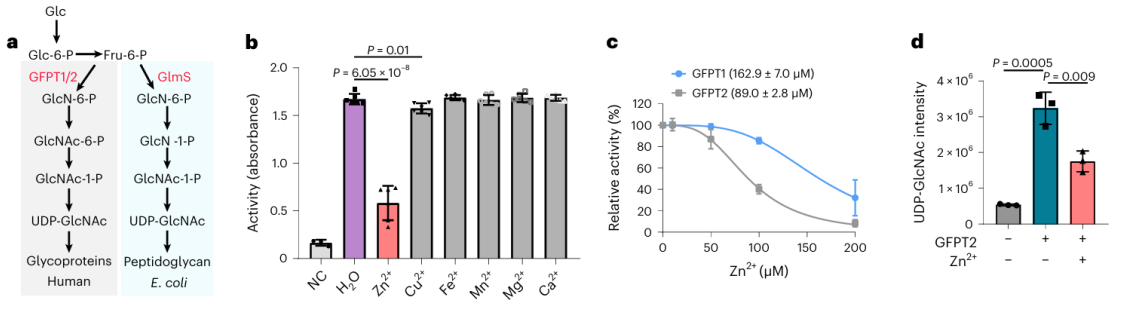
2. Влияние ионов цинка на потенциальный металлсвязывающий белок GFPT2.
Среди этих 17 потенциальных металлосвязывающих белков исследователи выбрали для проведения углубленную биохимическую проверку белка GFPT2. GFPT1/2 служит первым ферментом, ограничивающим скорость биосинтеза гексозы, способствуя образованию вещества под названием UDP-GlcNAc. Исследователи подтвердили на клеточном уровне, что ионы цинка взаимодействуют с GFPT2, подавляя его активность. Кроме того, они заметили, что присутствие ионов цинка приводит к значительному снижению уровней UDP-GlcNAc, указывая на то, что ионы цинка регулируют путь биосинтеза гексозы, ингибируя активность GFPT2. Интересно, что ионы цинка проявляют разную селективность в ингибировании активности GFPT2 и GFPT1, что указывает на наличие нового регуляторного механизма.
3. Расшифровка молекулярного механизма влияния ионов цинка на активность фермента GFPT2 и GLMS.
Исследователи выделили гомолог белка GFPT2 из E. coli и приступили к серии биохимических экспериментов и анализа кристаллической структуры. Результаты показали, что белок GLMS обладает способностью связывать ионы цинка, причем это связывание происходит вблизи области связывания субстрата. Это предполагает потенциальный сценарий, при котором ионы цинка могут конкурировать за связывание в активном центре GLMS и GFPT2 или препятствовать активности обоих ферментов, образуя координационные связи с их активными центрами.

4.Хелатор металлов TPEN может специфически распознавать белки, связывающие ионы цинка.
Наконец, исследователи расширили возможности METAL-TPP по идентификации металлсвязывающих белков в белках человека, используя хелатор металлов TPEN. Результаты экспериментов показали, что среди 150 белков с пониженной термостабильностью 110 (73%) были известными металлсвязывающими белками, что указывает на то, что TPEN, как и ЭДТА, может специфически распознавать металлсвязывающие белки. Среди них 95 (86%) известных металлсвязывающих белков были белками, связывающими ионы цинка, в то время как только 41% белков с пониженной термостабильностью, вызванной ЭДТА, были белками, связывающими ионы цинка, что позволяет предположить, что TPEN предпочитает идентифицировать ионы цинка. -связывающие белки.
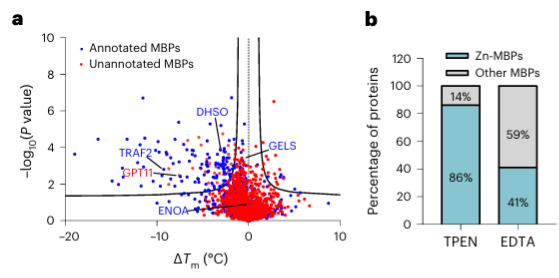
Среди 40 идентифицированных потенциальных металл-связывающих белков авторы выбрали один целевой белок, GPATCH11, для предварительной биохимической проверки и обнаружили, что этот белок является белком, связывающим ионы цинка.
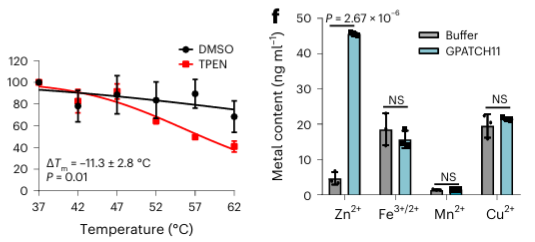
5. Сравнение способности распознавания двух хелаторов металлов в МЕТАЛЛ-ТПП.
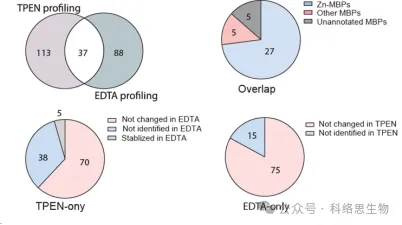
Исследователи также сравнили способность двух хелаторов металлов, TPEN и EDTA, идентифицировать белки с пониженной термостабильностью в данных протеомики METAL-TPP. Они обнаружили, что среди 37 белков, идентифицированных обоими хелаторами, 27, как известно, связывают цинк, 5, как известно, связывают другие металлы, а 5 ранее не были отмечены как белки, связывающие металлы. Для белков, термическая стабильность которых снижалась под действием одного хелатора и оставалась неизменной или повышалась под действием другого, исследователи предположили две возможные причины различия в диапазоне идентификации с помощью METAL-TPP. Во-первых, каждый хелатор может действовать как связывающий лиганд в некоторых белках, делая их более стабильными и противодействуя дестабилизирующему эффекту, вызванному связыванием металлов. Во-вторых, из-за различной молекулярной структуры два хелатора также имеют сильно разную растворимость в воде. Таким образом, будущие исследования METAL-TPP могут быть проведены с использованием других хелаторов с уникальной молекулярной структурой для более полного изучения возможностей металлопротеома.
В целом, это исследование представило новый метод METAL-TPP, который служит мощным инструментом для проведения протеомных исследований связывания металлов. Благодаря этому подходу исследователи систематически идентифицировали металлсвязывающие белки и выяснили их роль в биологических функциях и патогенезе. Это начинание не только создает важные базы данных, но также дает ценную информацию для понимания биохимических функций и потенциала металлсвязывающих белков в разработке лекарств, тем самым способствуя дальнейшим исследованиям в смежных областях.

