
Продукты
Новые терапевтические перспективы традиционной медицины: технология ABPP раскрывает новую противовоспалительную мишень берберина EIF2AK2
Традиционная медицина возрождается благодаря новым фармакологическим применениям, поскольку передовые методы, такие как профилирование белков на основе активности (ABPP), проливают свет на ранее неизвестные терапевтические механизмы. В этом контексте технология ABPP недавно выявила новую противовоспалительную мишень берберина, соединения, извлеченного из традиционных китайских лекарственных растений и широко известного в Китае как коптизин или хуанлянь. Это открытие подчеркивает, что EIF2AK2 играет ключевую роль в противовоспалительном действии берберина, открывая новые возможности для его использования в лечении заболеваний, связанных с воспалением. Этот прорыв подчеркивает потенциал перепрофилирования и оптимизации традиционных лекарств с помощью современных научных методов.

Берберин, традиционный алкалоид с широким спектром фармакологических эффектов, включая противовоспалительное, гипогликемическое и сердечно-сосудистое действие, привлек значительное внимание. Однако его точные молекулярные механизмы, особенно в подавлении воспаления, остаются неясными.
Это исследование заполняет этот пробел в знаниях, используя технологию ABPP для идентификации EIF2AK2 как критической мишени, на которую оказывает противовоспалительное действие берберин. Полученные результаты углубляют наше понимание механизма действия берберина и обеспечивают научную основу для изменения позиционирования берберина и разработки новых противовоспалительных препаратов, нацеленных на EIF2AK2.
Команда использовала передовые хемопротеомные методы для систематического исследования взаимодействия берберина с внутриклеточными белками, подтвердив его специфическое связывание с EIF2AK2 и модуляцию его ферментативной активности. Это влияет на пути воспалительного ответа, эффективно подавляя прогрессирование воспаления. Этот значительный прорыв дает представление о противовоспалительном механизме берберина и поддерживает разработку новых методов лечения, нацеленных на EIF2AK2.
ChomiX предоставляет передовые услуги, такие как ABPP и CETSA, чтобы помочь исследователям в изучении механизмов действия лекарств и ускорении разработки новых лекарств.
Маршрут исследования
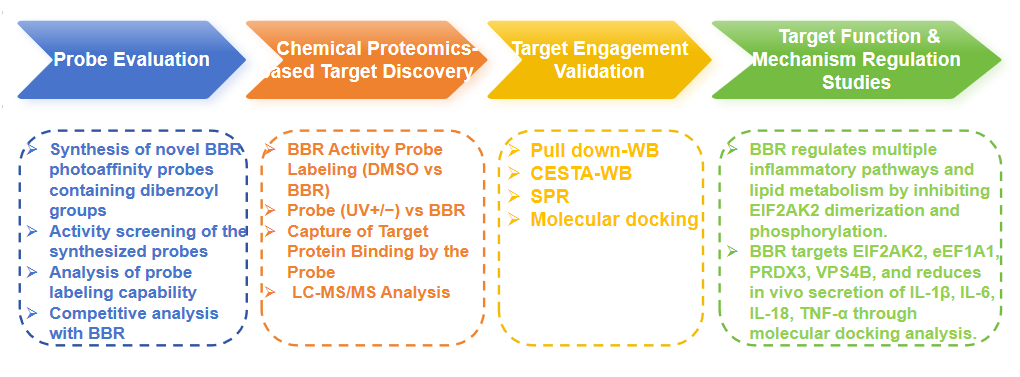
Экспериментальный процесс
1. Зонд 11b использовался в качестве функционального инструмента в протеомных исследованиях.
Авторы синтезировали и исследовали новые фотоаффинные зонды BBR, содержащие дибензоильные группы в макрофагах THP-1, активированных LPS + нигерицином. Среди них соединения 7a и 11b проявляли ингибирующее действие, зависящее от времени и дозы, на экспрессию IL-1β, демонстрируя повышенную эффективность по сравнению с исходным соединением BBR. С помощью анализа профилирования белков на основе активности (ABPP) и флуоресцентного сканирования было подтверждено, что как 7a, так и 11b эффективно связываются со своими целевыми белками и проявляют конкурентное ингибирование, что указывает на механизм действия, сходный с механизмом действия BBR. На основании наблюдения, что соединение 11b демонстрирует заметные изменения интенсивности флуоресценции в диапазоне концентраций от 2,5% до 25%, особенно при концентрации 20 миллимолярных, где изменение сигнала флуоресценции было наиболее заметным, оно было выбрано в качестве функционального зонда для протеомных исследований. . Этот выбор был основан на его превосходной отзывчивости, что делает его пригодным для выяснения белковых взаимодействий в протеомных условиях.
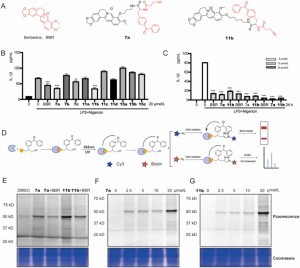
Рисунок 1: Скрининг и оценка зондов BBR.
2. Новый зонд 11b идентифицировал 44 связанных с воспалением целевых белка BBR в клетках THP-1 и выявил EIF2AK2, eEF1A1, PRDX3 и VPS4B как прямые мишени, специфически взаимодействующие с BBR.
Авторы в серии экспериментов успешно применили новый зонд 11b для маркировки и очистки потенциальных белков-мишеней в клетках THP-1. После этого они использовали анализ LC-MS/MS для идентификации 44 белков, связанных с воспалением, с молекулярной массой от 20 до 80 кДа, среди которых было обнаружено, что шесть потенциально играют решающую роль в противовоспалительном действии BBR. В дальнейших исследованиях было подтверждено, что EIF2AK2, eEF1A1, PRDX3 и VPS4B являются прямыми мишенями BBR, демонстрируя эффекты конкурентного ингибирования при высоких концентрациях обработки BBR. Это открытие раскрыло вероятное существование специфических взаимодействий между этими белками и BBR, тем самым проливая новое понимание их взаимодействия с препаратом во время его противовоспалительных процессов.
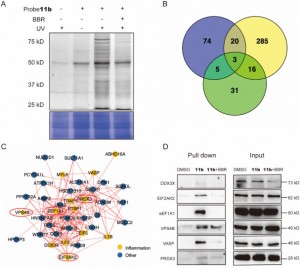
Рисунок 2: Захват целевых белков и функциональный анализ.
3. Исследования структурной биологии объясняют, как BBR модулирует димеризацию EIF2AK2, оказывая противовоспалительное действие посредством критических взаимодействий ионов и связывания катион-пи.
Авторы использовали методы CETSA, SPR и молекулярного докинга для проверки взаимодействия между BBR и четырьмя белками — EIF2AK2, eEF1A1, PRDX3 и VPS4B — в клетках HEK-293. Результаты показали, что BBR повышает термостабильность этих четырех белков, при этом наибольшее сродство наблюдается к EIF2AK2. Дальнейшие исследования показали, что связывание BBR с EIF2AK2 в основном зависит от ионных пар, включающих D316 и E367 в полости II, а также от взаимодействий катион-pi с K291. Этот сайт связывания участвует в димеризации EIF2AK2, что позволяет предположить, что BBR может оказывать свое противовоспалительное действие путем модуляции димеризации EIF2AK2.
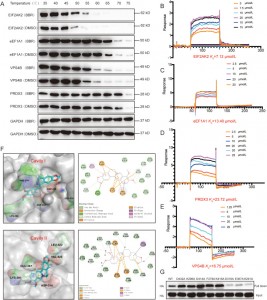
Рисунок 3: Исследования сходства между BBR и его потенциальными целями.
4. Роль BBR в путях воспаления и липидного метаболизма выявлена, поскольку он ингибирует димеризацию и фосфорилирование EIF2AK2, тем самым демонстрируя ключевую функцию в регуляции воспалительной сомы NLRP3, передачи сигналов NF-kB p65/JNK/SIRT1.
Эксперименты по иммунопреципитации подтвердили, что BBR ингибирует димеризацию EIF2AK2, влияя как на аутофосфорилирование EIF2AK2, так и на фосфорилирование его субстрата eIF2a, тем самым показывая, что BBR регулирует воспаление NLRP3, NF-kB p65, сигнальные пути JNK и экспрессию SIRT1, играя решающую роль в клеточных воспалительных реакциях. противовоспалительные механизмы головного мозга (например, при болезни Альцгеймера) и стресс эндоплазматической сети, индуцированный жирными кислотами. Кроме того, подавление или сверхэкспрессия EIF2AK2 значительно изменило регуляторные эффекты BBR на p-JNK и SIRT1, что еще раз доказывает, что BBR действует посредством связывания с EIF2AK2, регулируя связанные с воспалением нарушения липидного обмена.
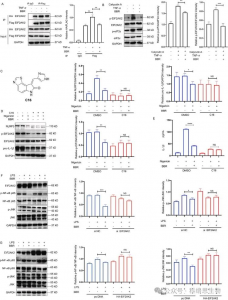
Рисунок 2. Захват целевых белков и функциональный анализ.
5. Нацеливаясь на EIF2AK2, eEF1A1, PRDX3 и VPS4B, BBR регулирует множество воспалительных путей, при этом EIF2AK2 играет доминирующую регуляторную роль среди этих мишеней.
Для дальнейшего изучения этого взаимодействия авторы создали модели сверхэкспрессии и нокдауна четырех белков, продемонстрировав, что BBR избирательно модулирует воспалительные пути JNK, NF-kB, MAPK и AKT, при этом EIF2AK2 играет доминирующую роль, что было подтверждено в экспериментах in vivo. .
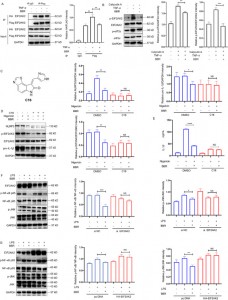
Рисунок 5: Функциональные исследования белков-мишеней BBR.
6. Благодаря специфическому нацеливанию на EIF2AK2, BBR подавляет секрецию in vivo IL-1β, IL-6, IL-18 и TNF-α; Нокдаун гена EIF2AK2 снижает его противовоспалительную эффективность и защитное действие на печень.
Затем они исследовали, влияет ли BBR на высвобождение IL-1β, IL-6, IL-18 и TNF-α, воздействуя на EIF2AK2 in vivo. Для этого они создали модель мыши с нокаутом гена EIF2AK2, используя внутривенную инъекцию аденоассоциированного вируса (AAV), несущего shEIF2AK2. Мышам дикого типа и нокаутным EIF2AK2 вводили BBR (3 мг/кг) внутрибрюшинно с последующей инъекцией LPS. Хотя BBR значительно снижал уровни IL-1β, IL-6, IL-18 и TNF-α в контрольной группе, этот эффект был ослаблен в группе с нокаутом EIF2AK2. Гистологическое исследование с помощью окрашивания H&E ткани печени показало, что улучшающий эффект BBR на инфильтрацию воспаления печени был ослаблен у мышей, нокаутных по EIF2AK2. Эти результаты позволяют предположить, что BBR потенциально снижает секрецию IL-1β, IL-6, IL-18 и TNF-α посредством воздействия на EIF2AK2 и демонстрирует хорошую безопасность.
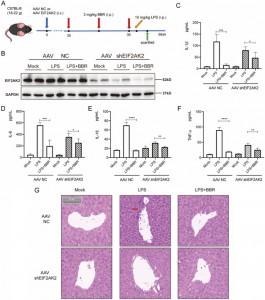
Рисунок 6: Функциональная проверка EIF2AK2 in vivo.
Это исследование полностью демонстрирует мощные преимущества технологии ABPP в выяснении сложных механизмов действия биоактивных молекул, таких как берберин, что способствует развитию современных исследований традиционных лекарств. Открывая новые цели и механизмы действия старого препарата берберина, это не только обогащает наше понимание биологических функций традиционных лекарств, но также открывает новые перспективы и возможности для лечения заболеваний, связанных с воспалением. Этот результат предвещает, что при поддержке современных научных методов, таких как ABPP, более традиционные лекарства будут перепрофилированы путем определения их конкретных целей и механизмов, что внесет значительный вклад в усилия по охране здоровья человека.
