Взаимодействия нуклеиновой кислоты и белка, выявленные с помощью стратегии бесконтактной маркировки: изучение зондов G4PID и стратегии PLGPB
В этой статье представлено инновационное исследование, в котором авторы представляют новый бифункциональный зонд под названием G4PID. Этот зонд сочетает в себе G4-связывающий домен (RHAU23) RHAU с биотинлигазой miniTurbo, что обеспечивает точное нацеливание на G-квадруплексы (G4) и маркировку белков, взаимодействующих с G4, в живых клетках. Структуры G4, образованные последовательностями нуклеиновых кислот, богатых гуанином, играют ключевую роль в различных клеточных процессах, включая регуляцию генов, репликацию ДНК и репарацию. Несмотря на широкое признание значения G4, специфические механизмы внутри клеток и их взаимодействие с белками остаются в значительной степени неизученными. Используя G4PID, авторы разработали специализированный метод мечения биотина (PLGPB) для точной идентификации и анализа белков, взаимодействующих с G4, что проливает свет на решающую роль структур G4 в клеточных функциях. Этот подход успешно идентифицировал 149 белков-кандидатов, взаимодействующих с G4, преимущественно участвующих в регуляции транскрипции, сплайсинге мРНК и ремоделировании хроматина. Проверка семи белков-кандидатов выявила их предпочтение связыванию РНК G4, хотя и с различным сродством к ДНК G4. Детальное изучение фактора сплайсинга SF3B4 продемонстрировало его взаимодействие со структурами G4, влияя на альтернативные события сплайсинга. Стабилизация структур G4 изменяла эффективность связывания SF3B4 и влияла на альтернативный сплайсинг специфических генов (например, INPPL1 и PPP6R2).

Берберин, традиционный алкалоид с широким спектром фармакологических эффектов, включая противовоспалительное, гипогликемическое и сердечно-сосудистое действие, привлек значительное внимание. Однако его точные молекулярные механизмы, особенно в подавлении воспаления, остаются неясными.
Это исследование заполняет этот пробел в знаниях, используя технологию ABPP для идентификации EIF2AK2 как критической мишени, на которую оказывает противовоспалительное действие берберин. Полученные результаты углубляют наше понимание механизма действия берберина и обеспечивают научную основу для изменения позиционирования берберина и разработки новых противовоспалительных препаратов, нацеленных на EIF2AK2.
Команда использовала передовые хемопротеомные методы для систематического исследования взаимодействия берберина с внутриклеточными белками, подтвердив его специфическое связывание с EIF2AK2 и модуляцию его ферментативной активности. Это влияет на пути воспалительного ответа, эффективно подавляя прогрессирование воспаления. Этот значительный прорыв дает представление о противовоспалительном механизме берберина и поддерживает разработку новых методов лечения, нацеленных на EIF2AK2.
ChomiX предоставляет передовые услуги, такие как ABPP и CETSA, чтобы помочь исследователям в изучении механизмов действия лекарств и ускорении разработки новых лекарств.
Маршрут исследования

Экспериментальный процесс
1. Проверка конструкции и характеристик датчика G4PID.
Первоначально авторы разработали зонд G4PID с G4-связывающим доменом RHAU23, расположенным на N-конце, и miniTurbo на C-конце, связанным гибким линкером. Экспрессию и очистку проводили с использованием штамма BL21 (DE3). Эксперименты по проверке специфического связывания с очищенным G4PID выявили его точное связывание с BCL2 G4, демонстрируя значение Kd 15 ± 7 нМ, демонстрируя при этом незначительное сродство к другим структурам, не относящимся к G4. Кроме того, авторы оценили специфичность биотинилирования G4PID, продемонстрировав его способность избирательно биотинилировать белки, взаимодействующие с G4.
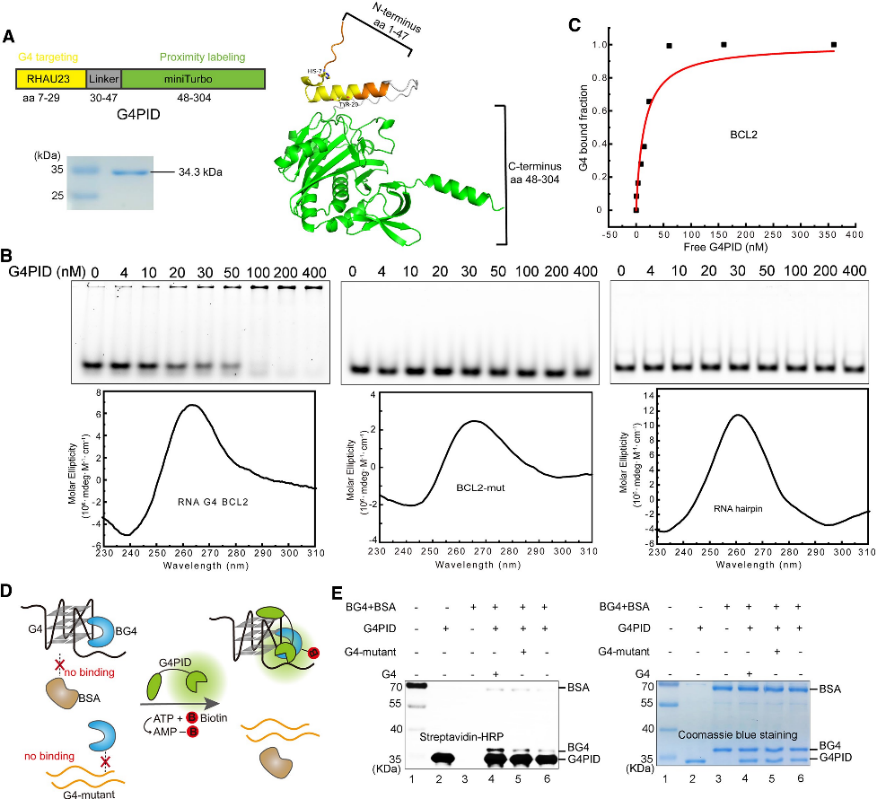
Рисунок 1. G4 PID опосредует специфическое биотинилирование белка, взаимодействующего с G4.
2. Способность G4PID связывать РНК G4 в клетках и характеристики мечения биотина.
Авторы создали клеточные линии HA-G4PID и HA-miniTurbo HeLa для исследования сродства связывания G4PID с внутриклеточной РНК G4 с помощью экспериментов eCLIP. Результаты демонстрируют избирательное взаимодействие G4PID с РНК G4, демонстрируя заметно более высокую аффинность связывания с последовательностями РНК, содержащими PQS, по сравнению со случайными последовательностями. Кроме того, авторы наблюдали уникальные особенности G4PID, способствующие инициации мечения биотина внутри клеток без необходимости использования кофакторов. Это привело к значительному повышению эффективности мечения белков: очевидные сигналы биотинилирования G4PID были обнаружены в течение 30 минут, что указывает на более быструю кинетику мечения по сравнению с miniTurbo.
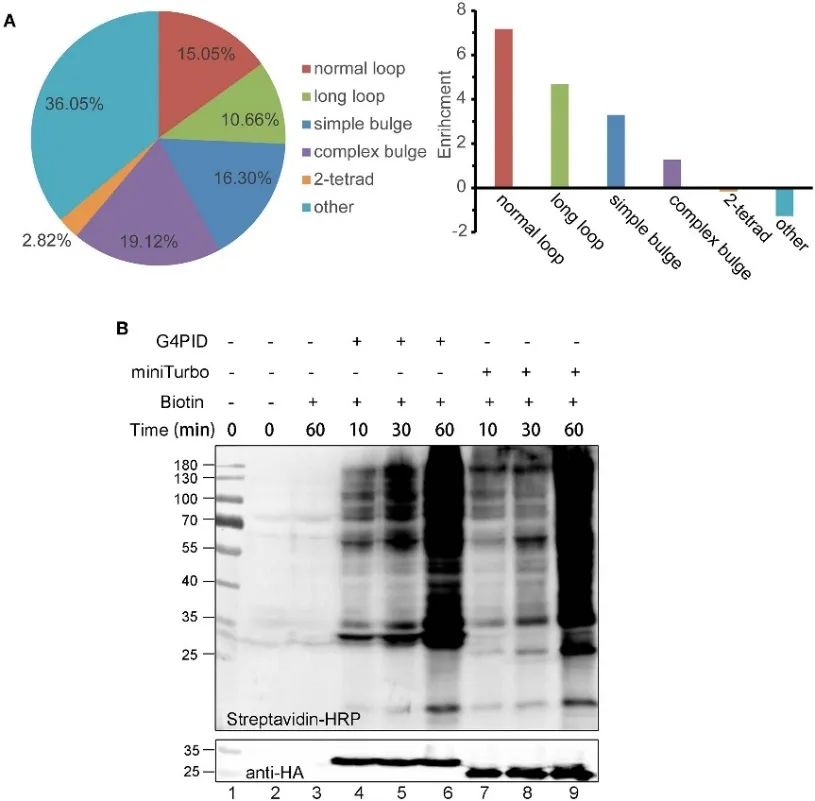
Рисунок 2. G 4 PID в сочетании с экспериментами с РНК G4 и оптимизацией эффективности мечения в клетках HEK293T.
3. Захват и обнаружение внутриклеточного протеома, взаимодействующего с G4, с использованием метода PLGPB.
Впоследствии авторы использовали зонд G4PID для захвата и обнаружения взаимодействующего с G4 протеома в живых клетках, используя подход бесконтактного мечения G4-взаимодействующих белков (PLGPB). В трех независимых повторных экспериментах, включающих 578 белков, с достижением 80% идентичности, была проведена трансфекция G4PID и miniTurbo в клетках HEK293T. Скрининг выявил 149 белков-кандидатов, взаимодействующих с G4, что демонстрирует значительное совпадение с существующими базами данных белков, взаимодействующих с G4. Кроме того, анализ обогащения Gene Ontology (GO) показал существенную связь этих белков с регуляцией транскрипции, сплайсингом мРНК и ремоделированием хроматина, что согласуется с предыдущими результатами исследований G4.
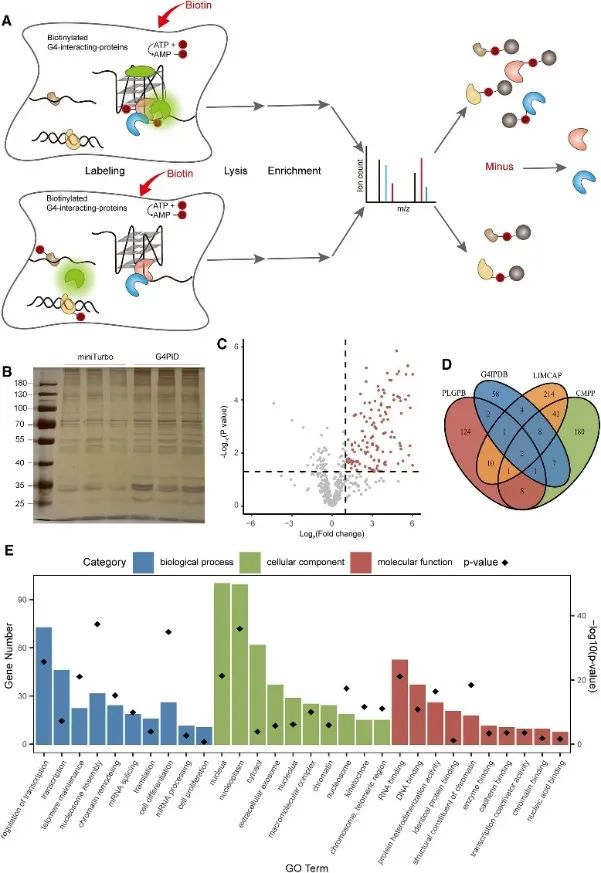
На рис. 3 идентифицированы белки, взаимодействующие с G4 методом PLGPB.
4. Проверка аффинности связывания G4 у вновь выявленных кандидатов.
С помощью метода PLGPB авторы обнаружили ряд кандидатов, охватывающих различные функциональные категории, включая общие белки, связанные с теломерами, транскрипционные факторы и относительно необычные белки, связывающие белки. Это указывает на то, что метод PLGPB не только подтверждает ранее признанные белки, взаимодействующие с G4, но также значительно расширяет белковый ландшафт, открывая новых кандидатов, охватывающих различные функциональные классы. Кроме того, авторы подтвердили способность этих кандидатов связываться с РНК G4 и ДНК G4, выявив выраженное предпочтение РНК G4 и вариации сродства к ДНК G4 в различных конформациях. Эти данные подчеркивают возможность модуляции взаимодействия белок-G4 путем регуляции конформации G4.
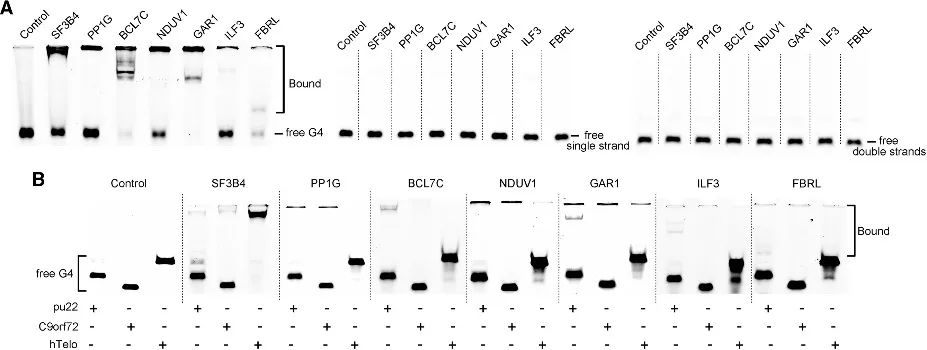
Рисунок 4. Взаимодействие белков-кандидатов с РНК G4 и ДНК G4.
5. Определение сайтов связывания с высокой степенью достоверности структуры SF3B4 и G4.
В ходе исследования способа связывания G4 in vivo авторы выявили важную роль белка SF3B4. Сайты связывания SF3B4, известного своим участием в сплайсинге РНК, были идентифицированы с высокой степенью достоверности с помощью экспериментов eCLIP и всестороннего анализа данных rG4-seq и DMS-seq. Примерно половина этих сайтов связывания содержала PQS, преимущественно связанный с нетрадиционными структурами G4. Более того, авт. наблюдали тесную пространственную связь между сайтами связывания SF3B4 и РНК PQS с обогащенным распределением преимущественно внутри интронных областей, особенно проксимальнее 3'-сайта сплайсинга. Эти данные убедительно подтверждают, что взаимодействие между SF3B4 и структурой G4 может играть решающую роль в альтернативных механизмах сплайсинга.
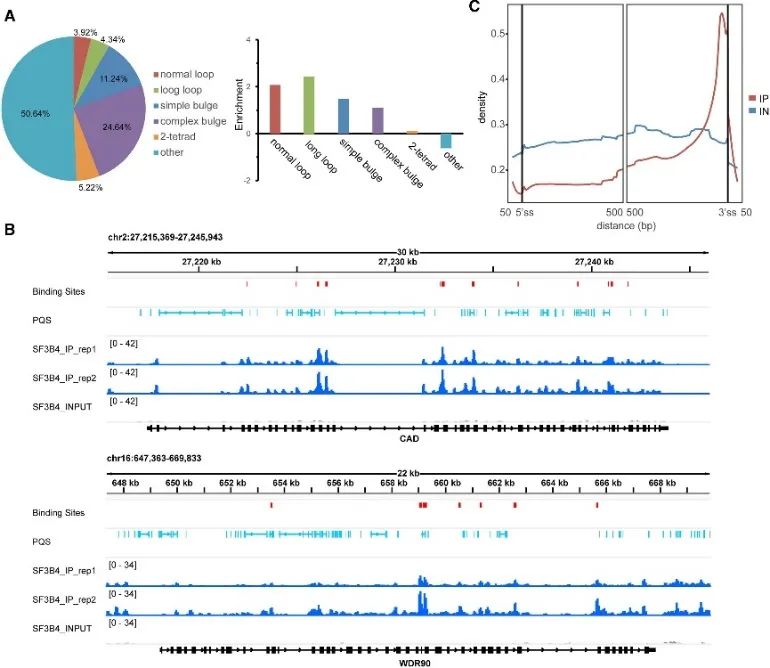
На рисунке 5 показано предпочтение связывания G4 SF3B4 в клетках с использованием технологии eCLIP.
6. Структура G4 регулирует альтернативный сплайсинг, опосредованный SF3B4.
Авторы провели анализ сайтов связывания SF3B4, чтобы выявить его связь со структурой G4, и дополнительно исследовали его регуляторный механизм в событиях альтернативного сплайсинга. Обычные PQS, участвующие в альтернативном сплайсинге, были проверены с использованием двух генов, INPPL1 и PPP6R2, выбранных для детального изучения. Были подтверждены структуры G4 в составе INPPL1 и PPP6R2, называемые G4-INPPL1 и G4-PPP6R2, а SF3B4 был идентифицирован как специфически связывающийся с этими структурами G4. Кроме того, было продемонстрировано, что добавление пиридостатина (PDS) лиганда G4 уменьшает связывание SF3B4 со структурами G4, что, следовательно, способствует событиям включения экзонов во время сплайсинга мРНК INPPL1 и PPP6R2. Эти данные указывают на потенциальное значение структуры G4 в SF3B4-опосредованном альтернативном сплайсинге.
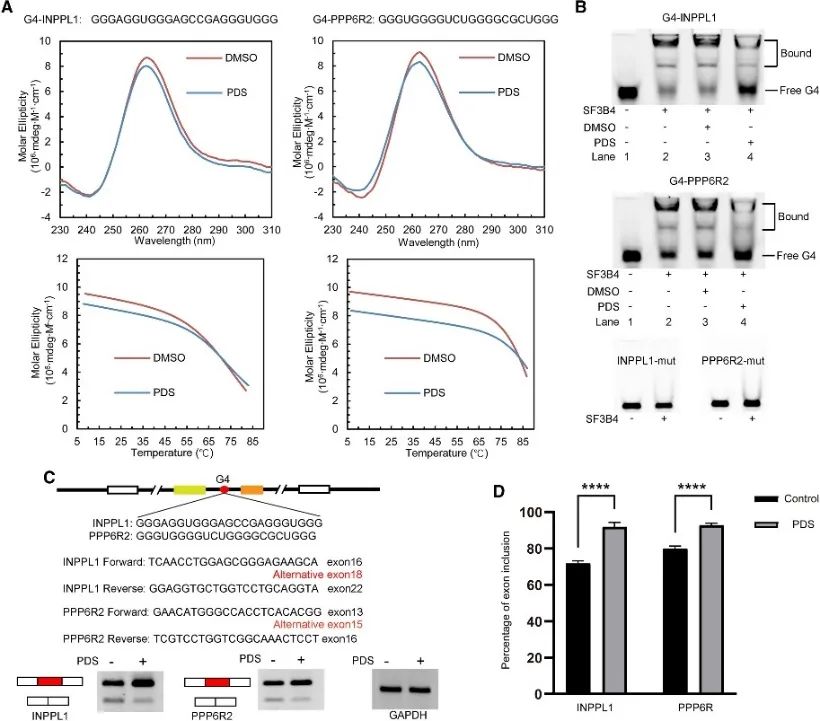
Рисунок 6. SF3B4 связывается со структурой G4 и влияет на альтернативный сплайсинг мРНК.
В заключение, это исследование представляет эффективный набор инструментов, включающий зонд G4PID и стратегию PLGPB, проливающий свет на то, как взаимодействие между G4 и белками внутри клетки влияет на экспрессию генов, особенно влияя на ключевой процесс альтернативного сплайсинга. Эти результаты углубляют наше понимание регуляторных механизмов, связанных с G4, в клеточных биологических процессах и открывают путь для дальнейшего изучения терапевтических стратегий для заболеваний, связанных с G4.

