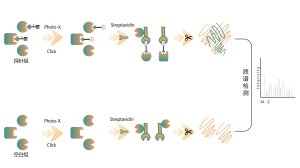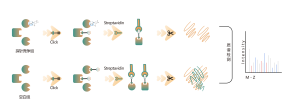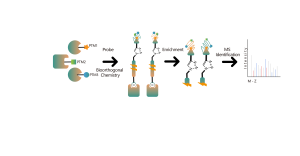Продукты
Анализ посттрансляционных модификаций белков (ПТМ) на основе химических зондов
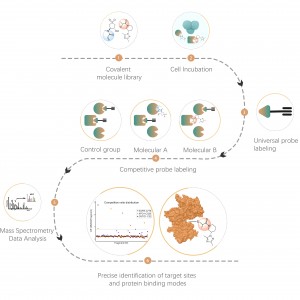
В дополнение к традиционным стратегиям обогащения антител для обогащения и идентификации посттрансляционных модификаций (ПТМ) в белках постепенно стали применяться методы химического, ферментативного и метаболического мечения. Основной принцип предполагает использование химической реакции или ферментативного катализа для ковалентного присоединения определенных молекулярных зондов к целевым модификациям или модифицирующим остаткам с последующим протеомным анализом. Этот новый подход в хемопротеомике становится важным при изучении модификаций белков с низким содержанием, таких как пальмитоилирование, миристоилирование и гликозилирование. Примечательно, что его преимуществом является возможность применения в живых клетках, что позволяет избежать потенциального вмешательства, такого как окисление, возникающее в результате клеточного стресса.

Техническая служба
1. Посттрансляционные модификации цистеина
Цистеин (Cys) — распространенная серосодержащая аминокислота в белках, и ее тиоловая группа играет решающую роль в регуляции молекулярного окислительно-восстановительного гомеостаза, влияя на ферментативные реакции, межбелковые взаимодействия и стабильность белков посредством разнообразных процессов посттрансляционной модификации. Общие посттрансляционные модификации цистеина включают пальмитоилирование, нитрозилирование, сульфенилирование и сульфирование. Компания Colosseum Biosciences разработала универсальные зонды или стратегии метаболической маркировки, нацеленные на остатки цистеина, и создала соответствующие платформы химической протеомики для идентификации посттрансляционных модификаций. Эта платформа точно идентифицирует целевые белки и сайты посттрансляционных модификаций.
2. Посттрансляционные модификации лизина
Лизин (Lys) — одна из аминокислот с наиболее разнообразными посттрансляционными модификациями (ПТМ) в протеоме. Обратимые посттрансляционные модификации лизина (Lys-PTM) представляют собой распространенные биохимические процессы, которые играют незаменимую роль в регуляции многочисленных критических клеточных функций. Посттрансляционные модификации лизина включают ацетилирование, сукцинилирование, пропионилирование, бутирилирование, кротонилирование, малонилирование и лактилирование. Компания Colosseum Biosciences разработала технологическую платформу химической протеомики, основанную на химических зондах для посттрансляционных модификаций лизина, которая точно идентифицирует целевые белки и сайты модификации.
3. Посттрансляционные модификации серина/треонина.
Общие посттрансляционные модификации серина (Ser) и треонина (Thr) в основном включают фосфорилирование, O-гликозилирование и т. д. Эти модификации существенно влияют на состояние активности белков и их взаимодействие с другими молекулами, играя важную роль в различных ключевых биологических процессах. Таким образом, анализ этого типа посттрансляционной модификации является важной темой в исследовании функций белков. Colosseum Biosciences использует материалы, обогащающие фосфорилирование, неприродные химические зонды с гликанами и другие инструменты для точной идентификации целевых белков и сайтов модификации для этого типа посттрансляционной модификации.
Наши преимущества
01. Высокий профессионализм:Работает исследовательская группа профессора Ван Чу из Пекинского университета, главного ученого нашей компании.
02. Универсальная платформа:Охватывает весь рабочий процесс: от проектирования зондов, синтеза зондов, обнаружения мишеней до биоинформатического анализа.
03. Нет необходимости в антителах:Специальная модификация химического зонда,Физиологический
04. Окружающая среда:Применимо как в лизатах, так и в живых клетках.
05. Обширный опыт:Накопленный опыт работы с более чем 10 различными типами PTM.
06. Высокопроизводительная платформа:Thermo Fisher Orbitrap Exploris 480,Thermo Fisher Q Exactive HF-X,Брукер ТимсТОФ
Тематическое исследование
Итаконация относится к процессу, при котором итаконат ковалентно связывается со специфическими участками белков во время посттрансляционной модификации. Эта модификация может изменить структуру и функцию белка, влияя на его роль внутри клетки. Например, итаконация может регулировать активность, стабильность или взаимодействие ферментов с другими молекулами. Поскольку итаконат является промежуточным продуктом цикла трикарбоновых кислот, эта модификация тесно связана с метаболическим состоянием клетки. Исследования показали, что итаконация играет значительную роль в патологии некоторых заболеваний, и понимание этого механизма модификации может помочь в разработке новых терапевтических стратегий.
Клетки, метаболически помеченные зондами ITalk на уровне живых клеток, лизировали с последующей клик-реакцией, обогащением, ферментативным расщеплением и другими этапами для определения конкретного места итаконового подкисления.