Раскрытие тайны малых молекул WA: пролить свет на регуляцию фермента PHGDH и проложить путь к новым методам лечения рака
Серин, незаменимая аминокислота, выполняет различные важные биологические функции в живых организмах. Он не только служит фундаментальным компонентом синтеза белка, но также участвует в регуляции многочисленных метаболических путей, включая синтез нуклеотидов, метаболизм метионина и антиоксидантные функции. Среди этих путей фосфопируватдегидрогеназа (PHGDH) имеет решающее значение, поскольку она катализирует начальный этап пути синтеза серина, превращая 3-фосфоглицерат в 3-фосфогидроксипируват. Учитывая его центральную роль в метаболизме серина, любое нарушение функции PHGDH неразрывно связано с возникновением и прогрессированием многочисленных заболеваний, особенно рака.
В этой статье представлен инновационный подход, который использует методы химической протеомики и фенотипического анализа для идентификации соединения, способного ковалентно ингибировать PHGDH. Хотя большинство ингибиторов PHGDH, как правило, являются конкурентными по своей природе, авторы представляют витангулатин А (WA), природную небольшую молекулу, в качестве нового ковалентного ингибитора PHGDH. WA становится многообещающим ведущим соединением для разработки ингибиторов PHGDH. Более того, WA служит ценным зондом для изучения функциональности PHGDH и пути синтеза серина (SSP). Используя этот ингибитор, исследователи получают более глубокое понимание регуляторных механизмов, регулирующих метаболизм серина, тем самым открывая возможности для изучения потенциальных методов лечения сопутствующих заболеваний, особенно рака.
Это открытие не только предлагает многообещающие направления для разработки новых стратегий лечения наркозависимости, но также дает решающее понимание роли метаболизма серина в прогрессировании заболевания.
Маршрут исследования
Экспериментальный процесс
1. Сравнение WP и WA в экспериментах по цитотоксичности.
В ходе исследования автор разработал и синтезировал составной зонд, названный WP. Используя клетки рака толстой кишки человека (HCT-116) и нормальные клетки толстой кишки (NCM460), авторы заметили, что WP проявляет цитотоксичность, сравнимую с WA. Это позволяет предположить, что включение алкиновых маркеров существенно не изменило его цитотоксические эффекты. Кроме того, авторы отметили, что WA проявляет меньшую цитотоксичность в нормальных клетках толстой кишки, но более высокую цитотоксичность в клетках рака толстой кишки, что подчеркивает его повышенную селективность в отношении клеток рака толстой кишки.
Впоследствии авторы применили стратегию профилирования белков на основе активности (ABPP), используя зонд WP в клетках HCT-116. Этот подход привел к идентификации PHGDH как белка-мишени WA. Экспериментальная проверка была проведена с использованием анализов WB-pulldown, подтвердивших полученные результаты.
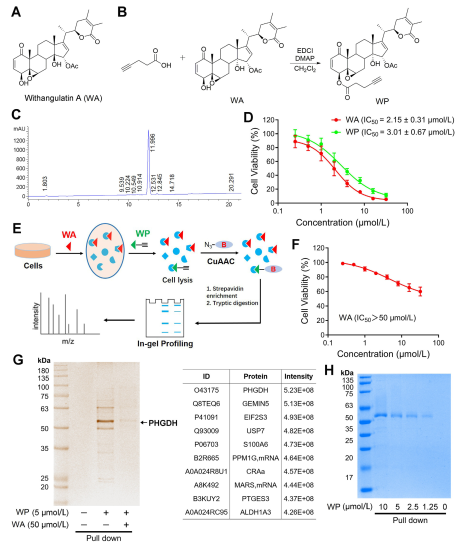
Рисунок 1: Подход химической протеомики для определения целей витангулатина А.
2. Подтверждение прямого взаимодействия между WA и PHGDH.
Используя технологию профилирования белков на основе активности (ABPP), авторы идентифицировали PHGDH как прямую мишень соединения WA в клетках HCT-116. Чтобы подтвердить взаимодействие между WA и PHGDH, авторы провели эксперименты по целевой стабильности, реагирующей на сродство к лекарственному средству (DARTS) и анализу клеточного термического сдвига (CETSA). Результаты показали, что WA повышала термическую стабильность PHGDH и значительно ингибировала его активность. Кроме того, эксперименты по биослойной интерферометрии (BLI) предоставили дальнейшее подтверждение прямого взаимодействия между WA и PHGDH.
Авторы также исследовали необратимую природу связывания WA с PHGDH. Их эксперименты показали, что PHGDH предотвращает связывание WP; однако предварительная инкубация с растворами, содержащими N-ацетилцистеин (NAC) или глутатион (GSH), может обратить вспять связывание WP с PHGDH. Эти данные свидетельствуют о необратимом ковалентном связывании между WA и остатками цистеина в белке PHGDH.
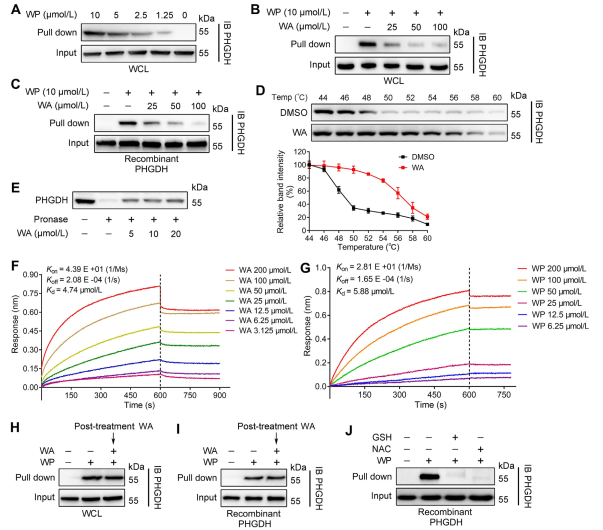
Рисунок 2. WA напрямую привязывается к PHGDH.
3. WA ковалентно связывается с PHGDH через α-β-ненасыщенный кетоновый фрагмент.
Для дальнейшего выяснения механизма взаимодействия WA с PHGDH исследователи провели эксперименты, чтобы подтвердить ковалентное связывание WA с PHGDH через его α-β-ненасыщенную кетоновую структуру. Первоначально α,β-ненасыщенные кетоновые фрагменты WA были восстановлены с получением WA-1 (см. часть рисунка 3A). Последующие анализы с использованием набора для подсчета клеток-8 (CCK-8) и анализа взаимодействия белков с понижением (см. рисунок 3B) продемонстрировали, что цитотоксический эффект WA действительно зависел от его α- и β-ненасыщенной кетоновой структуры. И наоборот, WA-1 не смог эффективно предотвратить связывание PHGDH с WP (см. Фигуры 3C и D), тем самым дополнительно подтверждая ковалентное связывание β-ненасыщенного кетона с PHGDH (см. Рисунок 3E).
Учитывая значительную роль ингибирования или отсутствия PHGDH в блокировании процессов пути синтеза серина (SSP) в опухолевых клетках, авторы приступили к исследованию влияния WA на активность SSP в клетках HCT-116 с использованием мечения стабильным изотопом U-13C-глюкозы (см. к рисунку 3J). Результаты экспериментов показали, что WA эффективно ингибирует активность SSP в клетках HCT-116.
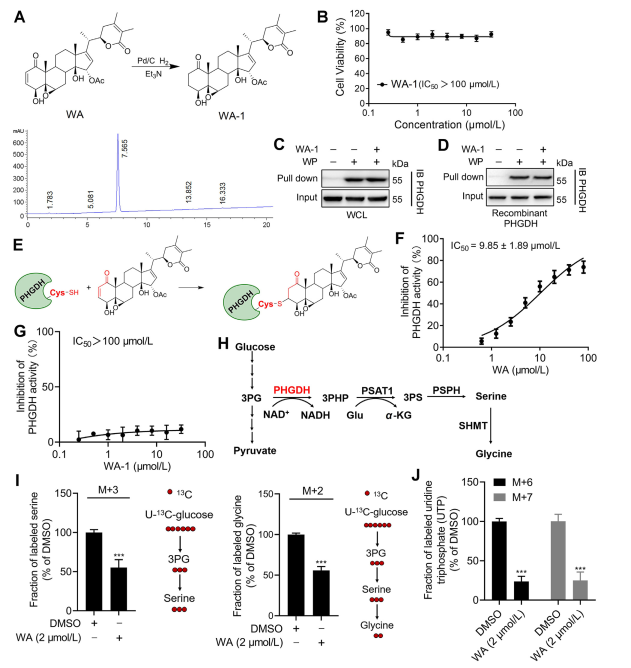
Рисунок 3: WA ковалентно связывается с PHGDH и ингибирует активность PHGDH.
4. Остаток Cys295 PHGDH ковалентно связан с WA.
Теоретически α- и β-ненасыщенные кетоновые фрагменты WA могут образовывать ковалентную связь с цистеиновыми остатками белка. Действительно, авторы наблюдали ковалентную модификацию остатков Cys295 в PHGDH под действием WA. Впоследствии они предоставили дополнительные доказательства ковалентного связывания WA с остатками Cys295 PHGDH и продемонстрировали, что мутации Cys295 значительно снижают ингибирующую активность WA в отношении PHGDH. Кроме того, эксперименты по биослойной интерферометрии (BLI) не выявили взаимодействия между WA и рекомбинантным белком Cys295A PHGDH, что подтверждает селективное ковалентное связывание WA с PHGDH.
Более того, молекулярно-динамическое моделирование показало, что WA функционирует как аллостерический регулятор PHGDH, при этом остаток Cys295 потенциально служит новым аллостерическим сайтом для PHGDH.
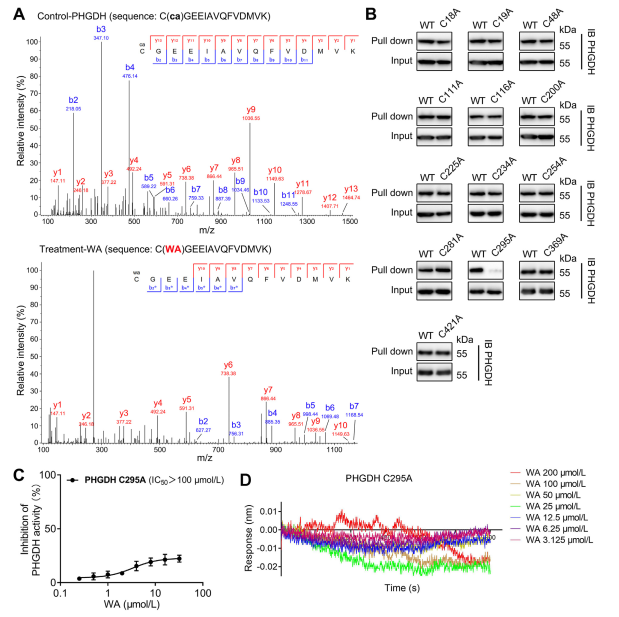
Рисунок 4. WA. Селективно ковалентно связывается с остатками Cys295 PHGDH.
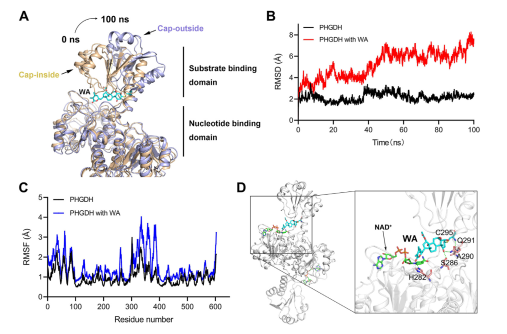
Рисунок 5: Остаток Cys295 как аллостерический регуляторный сайт PHGDH.
5. Влияние WA на окислительно-восстановительный баланс в клетках HCT-116.
Путь синтеза серина (SSP) играет ключевую роль в поддержании клеточного окислительно-восстановительного баланса, обеспечивая предшественников для синтеза глутатиона (GSH) и производства НАДФН, необходимых для окислительно-восстановительных реакций. Авторы исследовали влияние WA на окислительно-восстановительный баланс в клетках HCT-116 и заметили, что WA приводит к повышению уровня активных форм кислорода (АФК), что, как следствие, снижает соотношения GSH/GSSG и НАДФН/НАДФ+, что указывает на повышенный окислительный стресс.
Вестерн-блот-анализ выявил повышенную экспрессию γ H2AX, расщепленной каспазы 3 и расщепленного PARP, а также снижение экспрессии CHK2 и циклина D1, что указывает на индукцию апоптоза WA. Более того, потеря PHGDH приводила к увеличению продукции АФК, ингибированию пролиферации клеток HCT-116 и снижению цитотоксичности WA в клетках с низкой экспрессией PHGDH. Эти данные подчеркивают роль PHGDH в продукции АФК и WA-опосредованной цитотоксичности в клетках HCT-116.
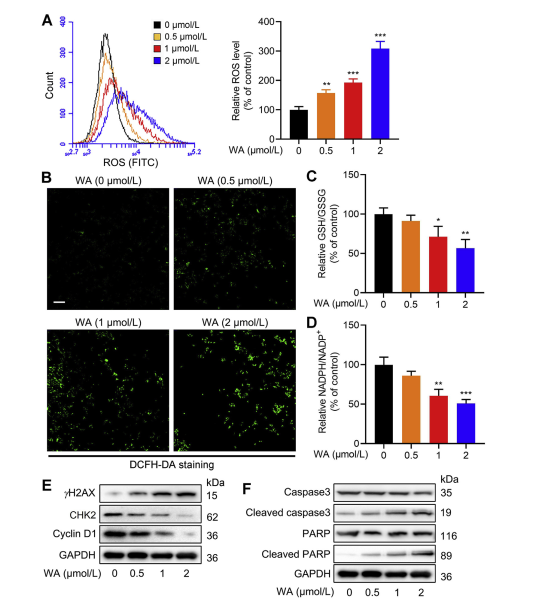
Рисунок 6: WA повышает уровень внутриклеточных АФК в клетках HCT-116.
6. Эффект пролиферации клеток в моделях ксенотрансплантатов.
Чтобы оценить влияние WA на пролиферацию клеток HCT-116 in vivo, авторы создали модель ксенотрансплантата с использованием клеток HCT-116. Результаты показали, что WA не оказывает существенного влияния на массу тела или морфологию органов, что указывает на низкую токсичность.
Для дальнейшего изучения селективности WA в отношении ингибирования PHGDH авторы создали модель ксенотрансплантата, используя клетки HCT116, нокаутные по PHGDH (KO). В этой модели отсутствие PHGDH заметно ингибировало пролиферацию клеток HCT-116 (см. рисунок 7, AC). Кроме того, экспрессия Ki67, маркера клеточной пролиферации, была значительно снижена в модели ксенотрансплантата клеток PHGDH KO HCT116 (см. Рисунок 7, D).
Примечательно, что в модели ксенотрансплантата с использованием клеток PHGDH KO HCT-116 WA не продемонстрировал значительного ингибирующего действия на пролиферацию клеток (см. Рисунок 7, EG), что еще раз подтверждает, что ингибирующее действие WA на клетки HCT-116 зависит от PHGDH.
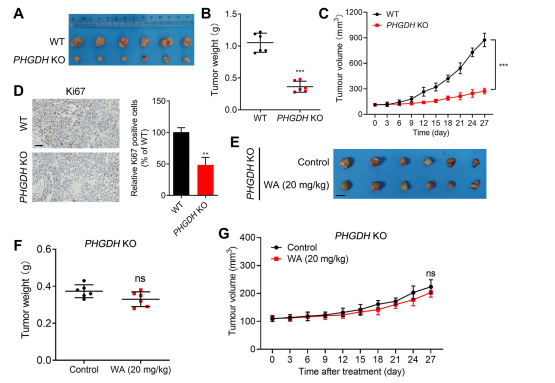
Рисунок 7: Влияние WA на пролиферацию клеток PHGDH KO HCT-116 in vivo.
Результаты этого исследования не только дают ключевые подсказки для будущей разработки противоракового препарата PHGDH, но также дают новую надежду и потенциал для разработки новых лекарств в области терапии рака.

