ABPP-analys avslöjar nya antiinflammatoriska mekanismer för itakonsyra via protein-metabolitinteraktioner
Itaconate, en endogen metabolit som är avgörande för inflammation och immunreglering, har sin roll belyst i en gemensam artikel av ChomiX Biotech-teamet. Studien använde innovativt ABPP-teknologi för att avslöja att itaconate modifierar S-glykosylering av cysteinrester på viktiga glykolytiska enzymer, och därigenom påverkar cellulär metabolism. Forskare kartlade protein-itakonatinteraktioner och fann att itakonat direkt binder och reglerar flera enzymer i glykolysvägen, vilket påverkar dess hastighet och riktning. Denna forskning främjar vår kunskap om metaboliska kontrollmekanismer under sjukdomsrelaterad inflammation och visar ABPPs styrka i att utforska hur små molekyler modulerar proteinfunktioner. Som ledare inom kemisk proteomik erbjuder Corolus BioScience omfattande lösningar, inklusive sonddesign, provbearbetning, screening med hög genomströmning och dataanalys, för att hjälpa kunder att upptäcka liknande metaboliska regulatoriska mekanismer.
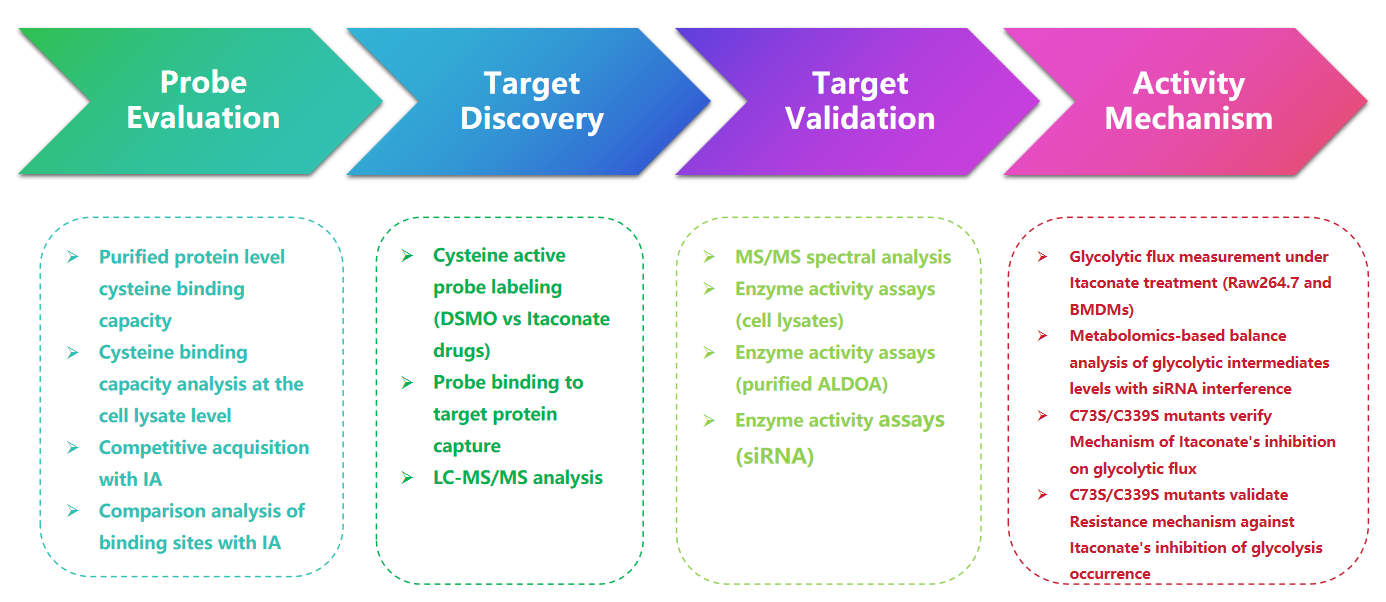
1. Detektering av Itaconate-modifieringar med 1-OH-Az-proben
I denna studie använde författarna avancerade profileringstekniker för att undersöka itakonatriktade cysteinrester. De utvärderade initialt sond 1-OH-Az genom gelelektrofores och utförde kompetitiva experiment med IA-alkyn. Massspektrometrivalidering bekräftade att 1-OH-Az selektivt märker cysteinställen, med 87% av nyligen identifierade proteiner som inte tidigare dokumenterats som ligandbindande proteiner i DrugBank. Med tanke på de olika funktionerna och sjukdomsrelevansen hos dessa proteiner kan 1-OH-Az-proben användas för att identifiera aktiva cysteiner som potentiella läkemedelsmål för nya terapier.
Figur 1: 1-OH-Az som en effektiv och distinkt cysteinanalysprob för att detektera itakonatmodifieringar
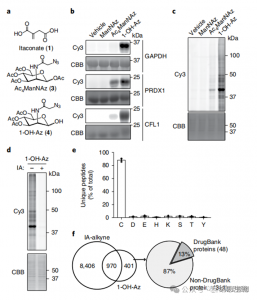
2. Identifiering av Itaconate-modifieringsplatser med hjälp av kvantitativa proteomiktekniker
Forskarna genomförde isoTOP-ABPP-experiment för att kvantifiera cysteinrester modifierade av itaconate med hjälp av 1-OH-Az-sonden. Efter förbehandling av lysat användes isotopiskt märkt linkerassisterad kvantitativ proteomik för att analysera effekten av olika koncentrationer av itakonat, för att fastställa dess specifika mål. Jämförande experiment gjordes också med två koncentrationer av IA-alkyn, som, samtidigt som de visade bredare aktivitet och täckning, endast kände igen 65 och 50 effektiva konkurrerande platser. Noterbart visade 1-OH-Az en signifikant högre konkurrensfördel bland samkvantifierade cysteiner.
Figur 2: Kemisk proteomisk analys av itakonat-modifierade cysteiner med användning av konkurrerande isoTOP-ABPP med 1-OH-Az
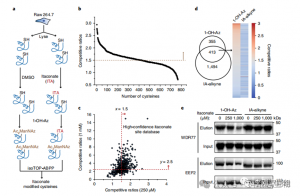
3. Itaconate Modifierar och hämmar ett nyckelglykolytiskt enzym
Massspektrometrisk analys visade att itakonat modifierar tre nyckelglykolytiska enzymer: ALDOA, GAPDH och LDHA. Endogen itakonatmodifiering på Cys73 och Cys339 av ALDOA bekräftades i LPS-stimulerade Raw264.7-celler. På grund av deras närhet spekulerade författarna att sådana modifieringar kan påverka aldolasaktivitet. Behandling med 1 mM itaconate ledde faktiskt till minskad ALDOA-enzymaktivitet utan att påverka proteinuttrycket. Dessutom visade isoTOP-ABPP-analyser att Cys84 på LDHA och Cys245 på GAPDH också är mål för itakonatmodifiering.

Figur 3: Itaconate kan modifiera och försämra ALDOA-funktionen
4. Itaconate undertrycker främst glykolys genom att rikta in sig på ALDOA
För att bedöma ITACs reglerande roll i inflammatorisk makrofagglykolys övervakade författarna glukoskonsumtion och laktatproduktion i Raw264.7-celler före och efter LPS-stimulering, vilket visar att ITAC signifikant minskade båda, vilket tyder på undertryckande av glykolytisk funktion. För att validera ITAC:s effekt på ALDOA och efterföljande hämning av glykolys, slog de ner endogen ALDOA med RNAi och överuttryckte antingen WT eller dubbelmutant (C73S/C339S) ALDOA i Raw264.7-celler. Som väntat resulterade nedbrytning av ALDOA i minskad glukoskonsumtion och laktatproduktion, vilket gjorde cellerna okänsliga för ITAC-behandling. Återinförande av WT eller mutant ALDOA återställde metabola nivåer i obehandlade celler; emellertid uppvisade celler som överuttryckte den muterade ALDOA minskad känslighet för glykolytisk hämning jämfört med WT. Enzymatiska analyser för aldolasaktivitet i linje med glykolytiska tillstånd.
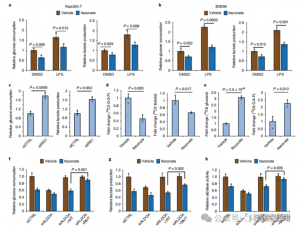
Figur 4: Itaconate ändrar den glykolytiska vägen genom att modifiera ALDOA
5. Hämning av ALDOA bidrar till antiinflammatoriska svar
Dessa fynd avslöjade att ITAC undertrycker glykolytisk vägaktivitet genom att modifiera cysteinrester Cys73 och Cys339 på ALDOA. Författarna drog vidare slutsatsen från den kända antiinflammatoriska effekten av dimetylfumarat via cysteinmodifiering på GAPDH och glykolytisk hämning att ITAC på liknande sätt kan återkoppla för att störa glykolysen för att utöva en antiinflammatorisk effekt. Nedbrytning av ALDOA minskade signifikant IL-1β-sekretion vid LPS-stimulering, vilket tyder på dess inblandning i att reglera inflammation genom glykolys. Att delvis vända de antiinflammatoriska effekterna av ALDOA-nedbrytning med kompletterat pyruvat indikerade en begränsad roll för LDHA i inflammatoriska svar.
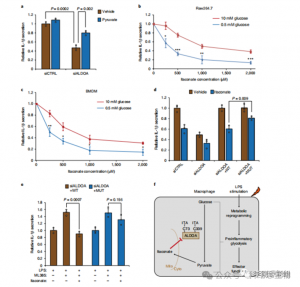
Figur 5: Itaconats antiinflammatoriska verkan medieras genom dess hämning av ALDOA, vilket resulterar i störningar av glykolysen
Sammanfattningsvis utnyttjade detta dokument effektivt S-glykosyleringsbaserade cysteinprofileringsteknologier och ABPP-metoder för att konstruera ett nätverk av interaktioner mellan itaconate och relaterade proteiner. Det visar övertygande att itaconate fungerar som en kritisk metabolisk regulator genom att specifikt modifiera cysteinrester på proteiner för att kontrollera den glykolytiska vägen. Denna forskning belyser inte bara verkningsmekanismen för itaconate som en ny metabolisk regulator utan ger också robusta bevis för hur små metaboliter interagerar med proteiner för att modulera kärnmetaboliska vägar.
Förutom ABPP inkluderar andra metoder för att studera interaktioner mellan småmolekylära metaboliter och proteiner, men är inte begränsade till:
1. Affinitetsanrikning (pull-down)tekniker, där den nativa föreningen omvandlas till en biotinylerad sond som inkuberar med cellysat, följt av streptavidin-medierad anrikning och isolering av proteinmål som binder till biotinsonden.
2.Begränsad proteolysmasspektrometri (LiP-MS)är en målupptäcktsteknologi baserad på proteinaffinitet. När specifika ligander, såsom läkemedel eller små molekyler, binder till särskilda proteiner, inducerar de konformationsförändringar eller steriska hinder som leder till differentiella klyvningsställen jämfört med det obundna proteinet. Genom att upptäcka dessa skillnader med masspektrometri kan denna metod identifiera läkemedel-proteininteraktioner inom celler och bestämma läkemedlets molekylära mål.
3.Cellular Thermal Shift Assay (CETSA)utvecklades ursprungligen för att hjälpa till med forskning mot cancerläkemedel och är en av de första allmänt använda etikettfria metoderna för att studera läkemedels-målengagemang i intakta celler. CETSA förlitar sig främst på principen att en förening vid bindning till ett målprotein ökar dess termiska stabilitet. Efter inkubering av prover med föreningen och motsvarande kontroller vid olika temperaturgradienter förblir proteiner bundna till liganden veckade och relativt stabila efter uppvärmning, medan obundna proteiner vecklas ut och fälls ut på grund av denaturering. Efterföljande analys av lösligt proteins termostabilitet genom immunblotting eller masspektrometribaserade tillvägagångssätt, baserat på deras smältkurvor, bekräftar interaktionen mellan föreningen och intracellulära proteiner.
4. Affinitetskromatografiinvolverar konjugering av målmetaboliten till en fastfasmatris för att fånga proteinkomplex som interagerar med den. De fångade proteinerna identifieras sedan med hjälp av tekniker som masspektrometri.
5.Ytplasmonresonans (SPR)används för etikettfri mätning i realtid av kinetiska parametrar associerade med interaktioner mellan små molekyler och proteiner.
6. Proteinkristallografibelyser de tredimensionella strukturerna av proteiner komplexbundna med små molekylligander, vilket ger en intuitiv inblick i bindningsställena och verkningsmekanismerna. Genom att lösa dessa strukturer kan forskare direkt visualisera hur de små molekylerna interagerar med deras proteinmål.

