Nya terapeutiska utsikter för traditionell medicin: ABPP-teknik avslöjar Berberines nya antiinflammatoriska mål EIF2AK2
Traditionell medicin vitaliseras med nya farmakologiska tillämpningar då avancerade tekniker som Activity-Based Protein Profiling (ABPP) kastar ljus över tidigare okända terapeutiska mekanismer. I detta sammanhang har ABPP-teknologi nyligen avslöjat ett nytt antiinflammatoriskt mål för berberin, en förening som utvinns från traditionella kinesiska medicinalväxter och allmänt känd som Coptisine eller Huanglian i Kina. Upptäckten lyfter fram EIF2AK2 som en nyckelspelare i berberins antiinflammatoriska effekter, vilket öppnar nya vägar för dess användning vid behandling av inflammationsrelaterade sjukdomar. Detta genombrott understryker potentialen för att återanvända och optimera traditionella läkemedel genom moderna vetenskapliga metoder.

Berberin, en traditionell alkaloid med omfattande farmakologiska effekter inklusive antiinflammation, hypoglykemi och kardiovaskulärt skydd, har rönt stor uppmärksamhet. Dess exakta molekylära mekanismer, särskilt vid inflammationsdämpning, förblir dock oklara.
Denna studie fyller denna kunskapslucka med hjälp av ABPP-teknik för att identifiera EIF2AK2 som ett kritiskt mål för berberin för dess antiinflammatoriska verkan. Fynden fördjupar vår förståelse av berberins mekanism och ger en vetenskaplig grund för att ompositionera berberin och utveckla nya EIF2AK2-riktade antiinflammatoriska läkemedel.
Teamet använde avancerade kemoproteomiska metoder för att systematiskt undersöka berberins interaktioner med intracellulära proteiner, vilket bekräftade dess specifika bindning till EIF2AK2 och modulering av dess enzymatiska aktivitet. Detta påverkar inflammatoriska reaktionsvägar, vilket effektivt hämmar inflammationsprogression. Detta betydande genombrott ger insikter i berberins antiinflammatoriska mekanism och stödjer utvecklingen av nya behandlingar riktade mot EIF2AK2.
ChomiX tillhandahåller banbrytande tjänster som ABPP och CETSA för att hjälpa forskare att utforska läkemedelsmekanismer och påskynda nya läkemedelsutvecklingsinsatser.
Forskningsväg
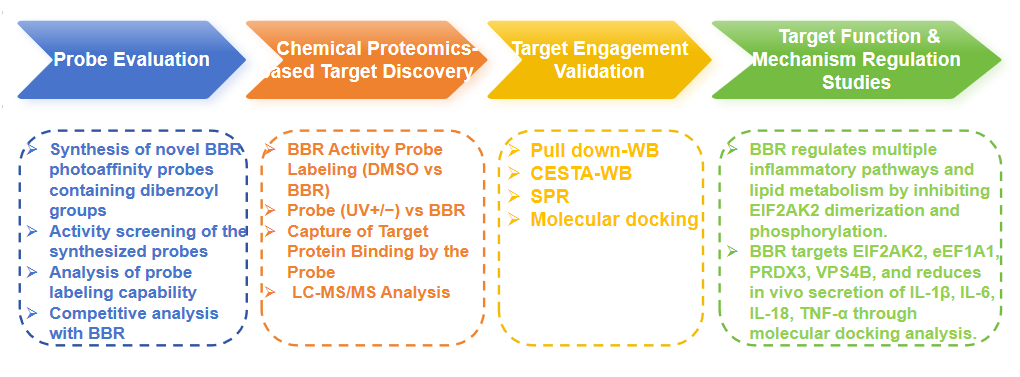
Experimentell process
1. Sond 11b användes som ett funktionellt verktyg i proteomikforskning.
Författarna syntetiserade och screenade nya BBR-fotoaffinitetsprober innehållande dibensoylgrupper inom LPS + Nigericin-aktiverade THP-1-makrofager. Bland dessa uppvisade föreningarna 7a och 11b tids- och dosberoende hämmande effekter på IL-1β-uttryck, vilket visar ökad effektivitet jämfört med moderföreningen BBR. Genom Activity-Based Protein Profiling (ABPP) analys och fluorescensskanning, bevisades det att både 7a och 11b effektivt binder till sina målproteiner och uppvisar kompetitiv hämning, vilket indikerar en verkningsmekanism som liknar den för BBR. Baserat på observationen att förening 11b uppvisade markanta förändringar i fluorescensintensitet inom koncentrationsintervallet 2,5 % till 25 %, särskilt vid en koncentration av 20 millimolar där fluorescenssignalvariationen var mest framträdande, valdes den som den funktionella sonden för proteomikstudier . Detta urval grundades i dess överlägsna lyhördhet, vilket gör det lämpligt för att belysa proteininteraktioner i en proteomisk miljö.
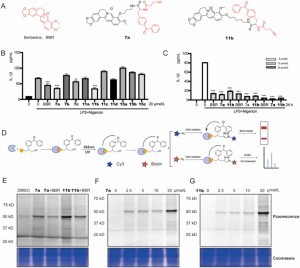
Figur 1: Screening och utvärdering av BBR-sonder.
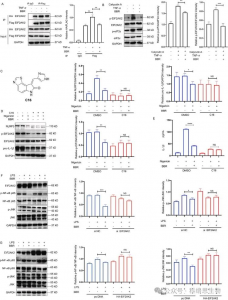
2. Den nya sonden 11b har identifierat 44 inflammationsrelaterade målproteiner av BBR i THP-1-celler, och den har avslöjat EIF2AK2, eEF1A1, PRDX3 och VPS4B som direkta mål med specifika interaktioner med BBR.
Författarna, genom en serie experiment, använde framgångsrikt den nya proben 11b för att märka och rena potentiella målproteiner i THP-1-celler. Efter detta använde de LC-MS/MS-analys för att identifiera 44 inflammationsassocierade proteiner i molekylviktsintervallet 20 till 80 kDa, bland vilka sex visade sig potentiellt spela avgörande roller i BBR:s antiinflammatoriska verkan. I ytterligare undersökningar bekräftades EIF2AK2, eEF1A1, PRDX3 och VPS4B som direkta mål för BBR, som uppvisar kompetitiva hämningseffekter under höga koncentrationer av BBR-behandling. Detta fynd avslöjade den sannolika förekomsten av specifika interaktioner mellan dessa proteiner och BBR, vilket belyser nya insikter om deras engagemang med läkemedlet under dess antiinflammatoriska processer.
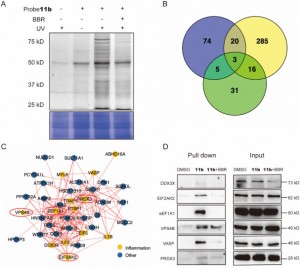
Figur 2: Infångning av målproteiner och funktionell analys.
3. Strukturell biologi forskning belyser hur BBR modulerar EIF2AK2-dimerisering för att utöva dess antiinflammatoriska effekter genom kritiska joninteraktioner och katjon-pi-bindning.
Författarna använde CETSA, SPR och molekylära dockningstekniker för att validera interaktionerna mellan BBR och fyra proteiner - EIF2AK2, eEF1A1, PRDX3 och VPS4B - i HEK-293-celler. Resultaten visade att BBR ökade den termiska stabiliteten för dessa fyra proteiner, med den starkaste affiniteten observerad för EIF2AK2. Ytterligare undersökning visade att bindningen av BBR till EIF2AK2 huvudsakligen är beroende av jonpar som involverar D316 och E367 i hålighet II, såväl som katjon-pi-interaktioner med K291. Detta bindningsställe är involverat i EIF2AK2-dimerisering, vilket tyder på att BBR kan utöva sina antiinflammatoriska effekter genom att modulera EIF2AK2-dimerisering.
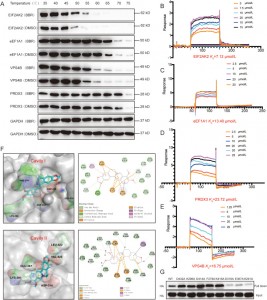
Figur 3: Affinitetsstudier mellan BBR och dess potentiella mål.
4. BBR:s roll i inflammations- och lipidmetabolismvägar avslöjas eftersom det hämmar EIF2AK2-dimerisering och fosforylering, vilket visar en central funktion för att reglera NLRP3-inflammasomen, NF-kB p65/JNK/SIRT1-signalering.
Immunoutfällningsexperiment bekräftade att BBR hämmar EIF2AK2-dimerisering, vilket påverkar både EIF2AK2-autofosforylering och fosforylering av dess substrat eIF2a, vilket avslöjar att BBR reglerar NLRP3-inflammasom, NF-kB p65, JNK-signalvägar och spelar en avgörande roll för SIRT1-cellsuttryck, hjärna antiinflammatoriska mekanismer (som vid Alzheimers sjukdom) och fettsyrainducerad endoplasmatisk retikulumstress. Dessutom förändrade tystnad eller överuttryck av EIF2AK2 signifikant BBR:s reglerande effekter på p-JNK och SIRT1, vilket ytterligare bekräftar att BBR verkar genom att binda till EIF2AK2 för att reglera inflammationsrelaterade lipidmetaboliska störningar.
Figur 2 Målproteinfångst och funktionell analys.
5. Genom att rikta in sig på EIF2AK2, eEF1A1, PRDX3 och VPS4B, justerar BBR flera inflammatoriska vägar, där EIF2AK2 spelar en dominerande regulatorisk roll bland dessa mål.
För att utforska denna interaktion ytterligare etablerade författarna överuttrycks- och knockdown-modeller av de fyra proteinerna, vilket visar att BBR selektivt modulerar JNK-, NF-kB-, MAPK- och AKT-inflammatoriska vägar, med EIF2AK2 som spelar en dominerande roll, vilket validerades i in vivo-experiment .
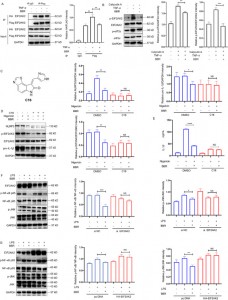
Figur 5: Funktionella studier av BBR-målproteinerna
6. Genom specifik målinriktning av EIF2AK2 nedreglerar BBR in vivo-utsöndringen av IL-1β, IL-6, IL-18 och TNF-α; nedbrytning av EIF2AK2-genen minskar dess antiinflammatoriska effekt och leverskyddande verkan.
De undersökte sedan om BBR påverkar IL-1β, IL-6, IL-18 och TNF-α-frisättning genom att rikta EIF2AK2 in vivo. För att göra det skapade de en EIF2AK2-gen knockout-musmodell med användning av intravenös injektion av adenoassocierat virus (AAV) som bär shEIF2AK2. Vildtyp och EIF2AK2 knockoutmöss administrerades BBR (3 mg/kg) intraperitonealt följt av LPS-injektion. Medan BBR signifikant minskade nivåerna av IL-1β, IL-6, IL-18 och TNF-α i kontrollgruppen, försvagades denna effekt i EIF2AK2-utslagsgruppen. Histologisk undersökning via H&E-färgning av levervävnad indikerade att den förbättrande effekten av BBR på leverinflammationsinfiltration var försvagad i EIF2AK2 knockoutmöss. Dessa fynd tyder på att BBR potentiellt nedreglerar utsöndringen av IL-1β, IL-6, IL-18 och TNF-α genom att rikta in sig på EIF2AK2 och uppvisar god säkerhet.
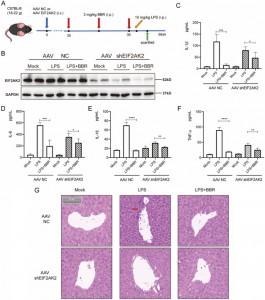
Figur 6: EIF2AK2 funktionella verifikationer in vivo.
Denna studie visar till fullo de kraftfulla fördelarna med ABPP-teknik för att klargöra de komplexa mekanismerna hos bioaktiva molekyler som berberin, vilket driver fram utvecklingen av modern forskning om traditionella läkemedel. Genom att avslöja nya mål och verkningsmekanismer för det gamla läkemedlet berberin berikar det inte bara vår förståelse för traditionella läkemedels biologiska funktioner utan öppnar också upp nya perspektiv och möjligheter för behandling av inflammationsrelaterade sjukdomar. Detta resultat förebådar att mer traditionella läkemedel, med stöd av moderna vetenskapliga tekniker som ABPP, kommer att återanvändas genom identifiering av deras specifika mål och mekanismer, vilket ger betydande bidrag till människors hälsoarbete.
Hänvisning:https://doi.org/10.1016/j.apsb.2022.12.009.

