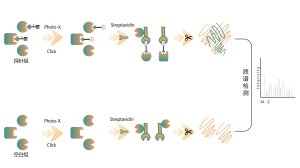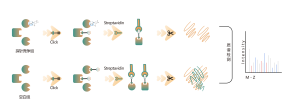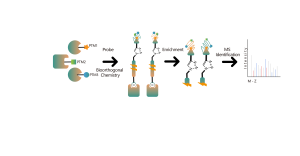Produkter
Kemoproteomisk profilering av proteinmål för icke-kovalenta småmolekylära läkemedel
Plattformens tekniska funktioner
Läkemedel med små molekyler spelar en viktig roll inom forskning och utveckling av läkemedel. De nuvarande FDA-godkända läkemedlen riktar sig mot totalt 812 distinkta mänskliga proteiner. Bland läkemedlen riktade mot de ovan nämnda målen är 84 % småmolekylära läkemedel. Dessutom har endast 639 av dessa proteiner varit målinriktade med småmolekylära läkemedel. Interaktionen mellan läkemedel med små molekyler och proteinmål inkluderar icke-kovalenta och kovalenta sätt, och den förra är för närvarande dominerande.
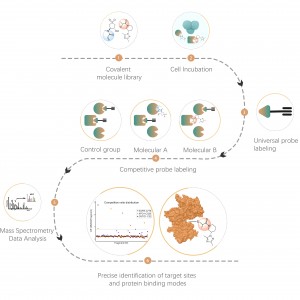
Icke-kovalenta interaktioner, såsom vätebindningar och π-π-stapling, kan störas på grund av proteindenaturering. För att möta denna utmaning använder vår plattform fotoaffinitetsmärkning, en väletablerad teknik för att exakt fästa "kemiska etiketter" till ett proteins aktiva plats. Dessutom omvandlar vår innovativa in situ kemiska tvärbindningsstrategi övergående icke-kovalenta proteininteraktioner till kovalenta och permanenta kemiska bindningar. Genom att använda en kemisk sond som är funktionaliserad med både fotoaffinitet och bioortogonala delar, har ChomiX:s kemoproteomikplattform visat sin effektivitet för att framgångsrikt fiska ut proteinmål inom cellysat, vävnader och levande celler. Spektrum av bioaktiva småmolekylära läkemedel som används i plattformen omfattar en mängd olika föreningar, inklusive endogena metaboliter, naturliga produkter och icke-kovalenta syntetiska molekyler.

Arbetsflöde

Plattformen följer ett strukturerat arbetsflöde, som börjar med märkning av levande celler med hjälp av en fotoaffinitetssond som härrör från icke-kovalenta molekyler. Efterföljande steg inkluderar extraktion av märkta proteomer, bioortogonal ligering, streptavidinbaserad anrikning, proteasspjälkning, isotopmärkning och slutligen masspektrometridetektion.
Fallstudie
Projektmål
Förening A visade god antiproliferationsaktivitet i cellviabilitetsanalysen. Chemoproteomics-plattformen användes för att karakterisera proteinmålen.
Experimentell metod
Den fotoaffinitetskemiska sonden, Sond A, designades och syntetiserades baserat på SAR-data för förening A. Sond A visade också liknande antiproliferationsaktivitet i tumörcellinjen. Gel- och MS-baserade experiment utfördes. MS-data analyserades för att klargöra MOA.
Datavisualisering

De gelbaserade fluorescensresultaten visade att prob A effektivt kunde märka proteiner, och märkningssignalen kunde tävlas avsevärt av förening A. Sammantaget indikerade dessa data att prob A kunde användas som det kemiska probverktyget för efterföljande målupptäckt sedan dess. det kan binda samma proteiner som förening A.



Vulkanplot visade att 114 proteiner (röd höjdpunkt) berikades av sond A signifikant i prob A vs DMSO (direkt)-gruppen, och 38 proteiner (röd höjdpunkt) konkurrerades av förening A signifikant i prob A vs (A+ sond A) ) (Tävling) grupp. Venn-diagram visade att 32 överlappande proteiner kunde vara potentiella förening A-bindande mål med hög tillförsikt.(n = 3, förhållande ≥2,p-värde ≤ 0,05)