Använda kemisk proteomik för att identifiera det funktionella målet SLC25A20 för Ingenol Mebutate för aktinisk keratos
Denna studie använder kemisk proteomik för att avslöja ett nytt mål för makromorolmetylbutylat (Ing-Meb), ett läkemedel som används för att behandla solkeratos. Forskargruppen utarbetade och syntetiserade initialt en Ing-Meb-fotoaffinitetsprob vid namn Ing-Dayne, som bildar kovalenta bindningar med målproteiner vid exponering för UV-ljus, vilket underlättar identifieringen av potentiella funktionella mål. Genom efterföljande validering identifierade författarna SLC25A20 som ett centralt mål för Ing-Meb. SLC25A20 är ett mitokondriellt membranbundet karnitin-acylkarnitin-translokas involverat i fettsyrametabolism. Noterbart leder den hämmande effekten av Ing-Meb på SLC25A20-funktionen till ökad ackumulering av långkedjiga acylkarnitiner, vilket bekräftar att Ing-Meb framkallar dess terapeutiska effekter genom att modulera fettsyraoxidationsvägen. Dessutom fördjupar studien betydelsen av strukturella förändringar i naturproduktundersökningar. Genom att syntetisera Ing-Daynes fotoaffinitetssond genom strukturell modifiering av Ing-Meb, har forskarna framgångsrikt grävt fram ett nytt mål som skiljer sig från konventionell förståelse. Detta förbättrar inte bara förståelsen av Ing-Meb och dess verkningssätt utan understryker också den centrala rollen av strukturell modifiering i kemisk proteomikforskning för att reda ut komplexiteten hos naturprodukter. Sådana insikter driver ytterligare läkemedelsinnovation, som omfattar optimering av befintlig läkemedelseffektivitet, utveckling av nya terapier riktade mot specifika enheter och förtydligande av läkemedelsbiverkningsmekanismer.
Forskningsväg
Experimentell process
1. Design av den syntetiska Ing-Dayne fotoaffinitetssonden avslöjar mekanismen bakom bindningen av Actinic Keratosis-läkemedlet Ing-Meb till dess målprotein.
I denna studie användes Ing-affinitetssonden Ing-Dayne, härledd från det terapeutiska läkemedlet Actinic Keratosis Ing-Meb (se figur 1). Genom samodling av denna sondmolekyl med specifika celler och efterföljande UV-ljusstrålning, bildade den dubbla akridinstrukturen i sonden stabila kovalenta bindningar med intracellulära proteiner. Vid cellysering underlättade en Click-kemisk reaktion bindningen av reportergruppen azid-tetrametylrhodamin till målproteinet (som illustreras i figur 2). Efterföljande SDS-PAGE-analys (avbildad i figur 3) avslöjade att Ing-Meb uppvisade en signifikant kompetitiv bindningseffekt på sonden, medan Ingenol, som hade en liknande struktur, inte visade kompetitiv hämning.
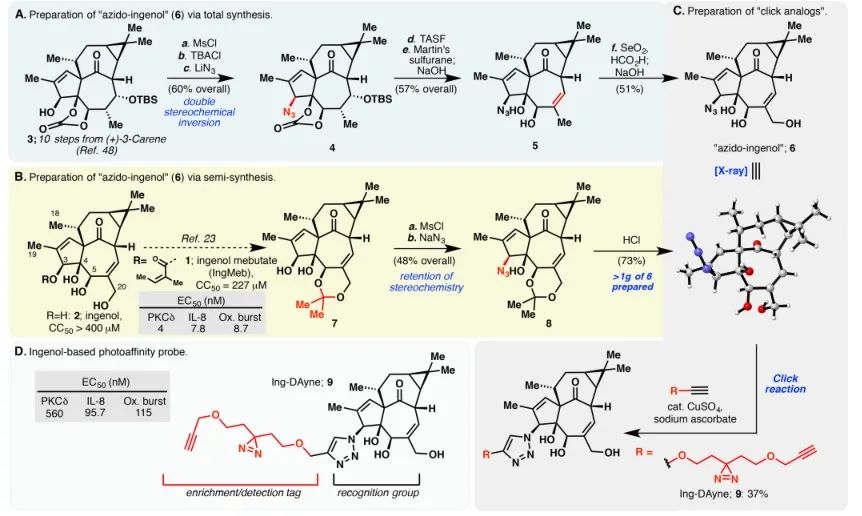
Figur 1: Illustrerar de två syntetiska vägarna som används för syntesen av Ing-Dayne.
2. Den nya sonden 11b har identifierat 44 inflammationsrelaterade målproteiner av BBR i THP-1-celler, och den har avslöjat EIF2AK2, eEF1A1, PRDX3 och VPS4B som direkta mål med specifika interaktioner med BBR.
Författarna, genom en serie experiment, använde framgångsrikt den nya proben 11b för att märka och rena potentiella målproteiner i THP-1-celler. Efter detta använde de LC-MS/MS-analys för att identifiera 44 inflammationsassocierade proteiner i molekylviktsintervallet 20 till 80 kDa, bland vilka sex visade sig potentiellt spela avgörande roller i BBR:s antiinflammatoriska verkan. I ytterligare undersökningar bekräftades EIF2AK2, eEF1A1, PRDX3 och VPS4B som direkta mål för BBR, som uppvisar kompetitiva hämningseffekter under höga koncentrationer av BBR-behandling. Detta fynd avslöjade den sannolika förekomsten av specifika interaktioner mellan dessa proteiner och BBR, vilket belyser nya insikter om deras engagemang med läkemedlet under dess antiinflammatoriska processer.
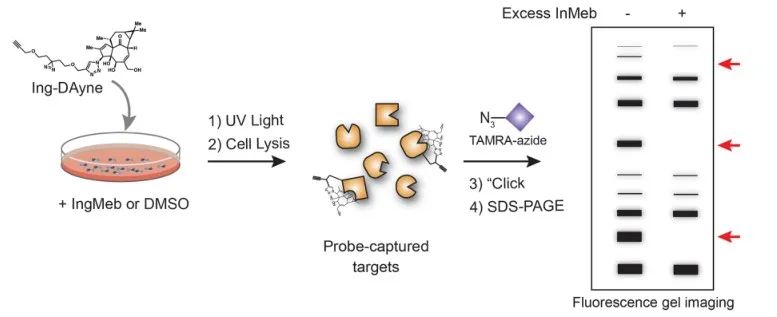
Figur 2: Gelbaserad valideringsprocess för Ing-Dayne-målet.
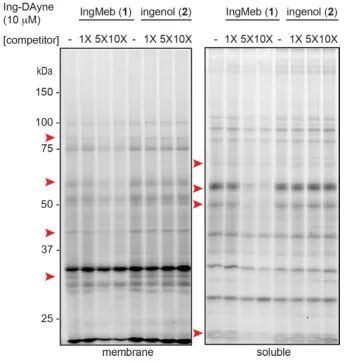
Figur 3: Konkurrensmässig inhibering av Ing-Meb och ingenol på sondmolekylen Ing-Dayne.
3. SILAC-screening, kombinerat med Western blot-validering, identifierade SLC25A20 som ett primärt mål för Ingenol-klassens läkemedel Ing-Meb.
Författarna screenade initialt 28 potentiella målproteiner med hjälp av stabil isotopmärkning med aminosyror i cellkultur (SILAC)-teknologi (Figur 4). Därefter, genom ytterligare screening och Western blot-valideringsexperiment (Figur 5), observerade forskarna att Ing-Meb uppvisade den starkaste hämmande effekten på SLC25A20 bland dessa kandidatmål, vilket starkt tyder på att SLC25A20 är ett av de centrala funktionella målen för Ing-Meb.
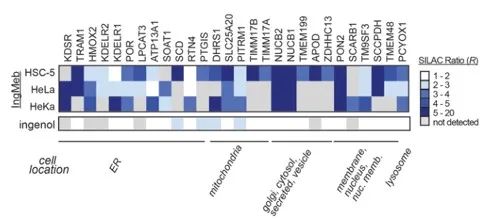
Figur 4: De 28 potentiella målen som erhållits genom den initiala screeningen.
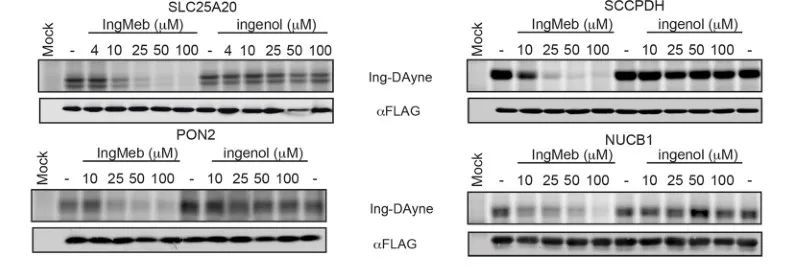
Figur 5: Western blot-experiment av fyra potentiella målproteiner.
4. Ing-Meb reglerar fettsyraoxidationsvägen genom att hämma SLC25A20, ett mitokondriellt membranprotein även känt som botulinum alkalilipoyltransferas, och avslöjar därmed dess mål som ett läkemedel för aktinisk keratos.
Författarna undersökte SLC25A20, även känd som botulinum alkali lipoyltransferas eller CACT, ett multimodalt integrerat membranprotein lokaliserat i mitokondriella membranet. Dess primära funktion innebär transport av långkedjiga acylkarnitiner in i mitokondrierna, vilket underlättar deras utbyte med fritt karnitin. Dessa transporterade acylkarnitiner omvandlas därefter till fettacylCoA av karnitinpalmitoyltransferas-2 (CPT-2), vilket fungerar som prekursorer för fettsyra-β-oxidation. Experimentella fynd avslöjade en signifikant ökning av cellulärt långkedjigt acylkarnitininnehåll med eskalerande koncentrationer av Actinic Keratosis-läkemedlet Ing-Meb (avbildat i figur 6). Denna observation stöder starkt Ing-Mebs hämmande effekt på SLC25A20, vilket bekräftar SLC25A20 som ett av de huvudsakliga målen som medierar verkan av Ing-Meb.
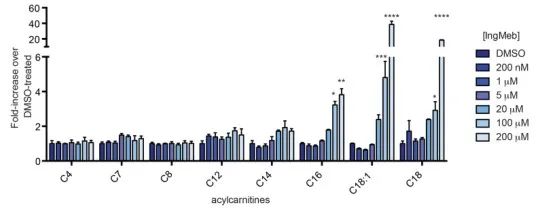
Figur 6: Effekt av Ing-Meb för långkedjiga acylkarnitiner
5. Indirekt validering av Ing-Meb cytotoxiska effekt via SLC25A20-uttryck: avslöjar dess målfunktion vid reglering av läkemedelsaktivitet.
Utredarna försökte direkt koppla inhiberingen av SLC25A20 i HeLa-celler med de potentiella cytotoxiska effekterna av Ing-Meb. Resultaten indikerade att även om överuttryck av SLC25A20 inte förändrade den halva hämmande koncentrationen av Ing-Meb i dessa celler, är det anmärkningsvärt att ökat SLC25A20-uttryck signifikant mildrade effekten av Ing-Meb på långkedjig acylkarnitinackumulering (visad i figur 7) . Detta resultat underbygger ytterligare hypotesen att SLC25A20 fungerar som ett centralt funktionellt mål för läkemedelsaktiviteten hos Ing-Meb.
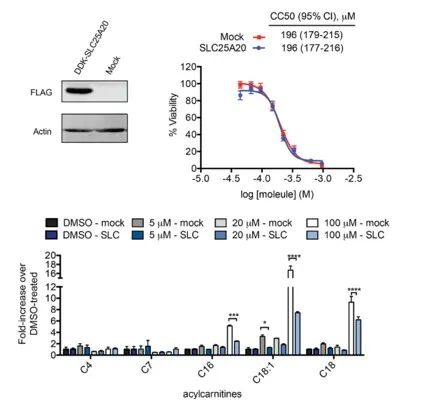
Figur 7: Effekt av uttryck eller inte av SLC25A20 på CC50 och acylkarnitin.
Denna studie avslöjar inte bara de nya målen för Ing-Meb, utan ger också en ny teoretisk grund och strategisk riktning för målupptäckten av strukturellt komplexa naturprodukter. Hänvisning:
Hänvisning:https://doi.org/10.1021/acscentsci.7b00420.

