
Produkter
Kemoproteomisk upptäckt av nya blystrukturer för ohärdiga mål
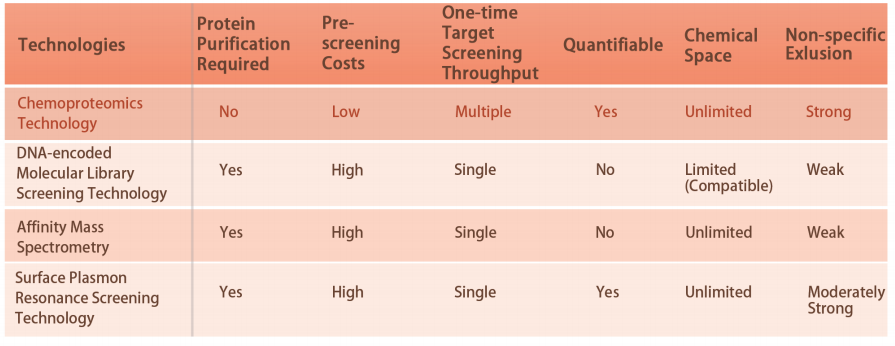
Teknisk bakgrund
För närvarande har endast ~800 proteiner varit måltavla av FDA-godkända läkemedel, och ett stort antal sjukdomsrelaterade mål är "odugliga". För för närvarande är de flesta teknologier beroende av renade proteiner. Tillkomsten av chemproteomics har revolutionerat läkemedelsupptäckten från renade proteiner till levande celler. Det är kapabelt att kvantitativt analysera interaktionerna mellan små molekyler och proteiner i den mänskliga proteomskalan. Nu har upptäckten av kovalenta strukturer mot specifika aminosyrarester av proteinmål, såsom cystein, lysin, metionin och tyrosin, visats i cellysat och levande celler. ChomiX kommer att utnyttja sin egen kemoproteomikplattform för att snabbt bryta igenom barriärerna för "odugliga" mål.

Tekniska fördelar
Plattformens tekniska funktioner
DIA-ABPP-plattformen är designad för att upptäcka kovalenta bindemedel som engagerar proteinmål genom kovalenta reaktioner med tiolgruppen av cysteinrester. När aktiva cysteinrester av proteiner är upptagna av kovalenta molekyler, kommer märkningen av den universella sonden som specifikt reagerar med tiolgruppen att konkurreras. I kombination med DIA-baserade kvantitativa proteomiktekniker kunde intensiteten av sondmärkta peptider mellan kovalent molekyl och kontrollgrupp kvantifieras. Dessa signalskillnader representerar ockupationshastigheterna för kovalenta molekyler mot deras bindande proteiner. Till skillnad från traditionella screeningstrategier med ett mål, möjliggör DIA-ABPP-plattformen kvantitativ analys av interaktioner mellan fragmentelektrofiler och nästan alla proteiner i levande celler med upplösningen av aminosyrarester, vilket avsevärt förbättrar effektiviteten och minskar risken för projektet för upptäckt av ledande strukturer med hög genomströmning. .

Arbetsflöde för screening av kovalent blyförening
Funktion 1

Vårt läkemedelsliknande molekylbibliotek innehåller en mängd olika reaktiva grupper (stridsspetsar) som kännetecknas av mild elektrofil reaktivitet såsom akrylamid, kloroacetamid och alkynamid. Dessa molekyler har strukturellt olika farmakoforer som överensstämmer med Lipinskis femmansregel.
Funktion 2

För närvarande täcker biblioteket av proteinmål som fångas av den tiolspecifika kemiska sonden 39962 cysteinställen från 12421 proteiner, inklusive kinas, fosfatas, ligaser och transkriptionsfaktorer. Biblioteket förblir kontinuerligt uppdaterat, vilket säkerställer tillgång till den senaste informationen om specifika mål och platser. Detaljerad information om specifika mål och webbplatser finns tillgänglig via länken nedan.
Funktion 3

I ett enda screeningsexperiment kan plattformen kvantifiera målengagemang av små molekyler (A2-H6) mot alla märkta proteiner i hela proteomen. Figuren ovan visar platsbeläggning av utvalda kliniskt viktiga mål av kovalenta molekyler. Ju mörkare färg, desto högre beläggning av molekyler till bindningsfickor, inklusive ortosteriska och allosteriska ställen (stjärnan indikerar att beläggningsgraden är högre än 80%). Således kan affiniteten och selektiviteten för varje molekyl utvärderas samtidigt för efterföljande strukturoptimering.




