[Nationell nyckelprojektfinansiering] Att reda ut metallbindande proteiner: METAL-TPP-genombrott och innovationer inom läkemedelsupptäckt
Metallbindande proteiner är avgörande komponenter som bildar stabila komplex med metalljoner, som tjänar olika vitala funktioner i levande organismer, inklusive cellsignalering, katalyserar biokemiska reaktioner och upprätthåller metalljonhomeostas. Deras dysreglering är förknippad med sjukdomar som cancer, neurologiska störningar och metabola sjukdomar. Att förstå deras roll i sjukdomspatogenes är avgörande för diagnos och behandling. Dessutom är metallbindande proteiner viktiga mål i läkemedelsutveckling, eftersom många läkemedel interagerar med dem för att utöva terapeutiska effekter. I denna studie introducerade forskare METAL-TPP, en toppmodern kemisk proteomikmetod. Genom att kombinera termostabilitet kvantitativ proteomisk analys (TPP) med metallbindande proteinidentifiering, möjliggör METAL-TPP effektiv och exakt detektion av metallbindande proteiner. Det reglerar särskilt proteinets termostabilitet med hjälp av en rad metallkelatorer, vilket underlättar exakt identifiering i rena proteiner och cellysat. Detta innovativa tillvägagångssätt ger nya insikter i metallbindande proteinfunktion och mekanismer, vilket underlättar biologisk forskning, sjukdomsförståelse och läkemedelsutveckling. Keloxi Biology tillhandahåller avancerade ABPPs, TPP och andra tekniska tjänster inom farmaceutisk FoU, stödjer forskare i att utforska läkemedelsmekanismer och främja nya läkemedelsutvecklingsprocesser.

Experimentell process
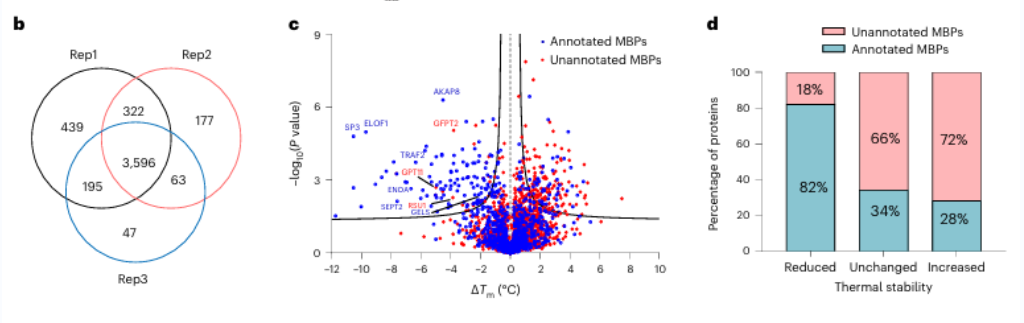
1. Sjutton potentiella metallbindande proteiner identifierades med användning av METAL-TPP.
Inledningsvis bedömde forskarna effektiviteten av bredspektrummetallkelering med EDTA på rena proteiner och cellysat. De observerade att METAL-TPP effektivt detekterade minskningar i termisk stabilitet hos metallbindande proteiner. Därefter genomfördes en systematisk analys av humant härledda proteiner med hjälp av METAL-TPP, vilket identifierade 125 proteiner som uppvisade minskad termostabilitet. Bland dessa var 102 tidigare kända metallbindande proteiner. Dessutom avslöjades 17 potentiella metallbindande proteiner utan föregående funktionell anteckning, vilket ger nya insikter om rollen av metallbindande proteiner.
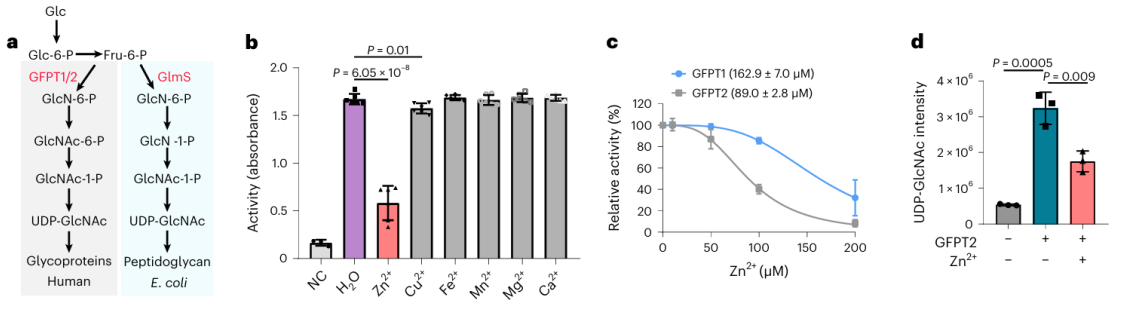
2. Effekten av zinkjoner på det potentiella metallbindande proteinet GFPT2.
Bland dessa 17 potentiella metallbindande proteiner valde forskare att genomföra en djupgående biokemisk validering av proteinet GFPT2. GFPT1/2 fungerar som det första hastighetsbegränsande enzymet i hexosbiosyntesvägen, vilket hjälper till att generera en substans som kallas UDP-GlcNAc. Forskare bekräftade på cellnivå att zinkjoner interagerar med GFPT2, vilket hämmar dess aktivitet. Dessutom observerade de att närvaron av zinkjoner leder till en signifikant minskning av UDP-GlcNAc-nivåer, vilket indikerar att zinkjoner reglerar hexosbiosyntesvägen genom att hämma aktiviteten av GFPT2. Intressant nog uppvisar zinkjoner olika selektivitet när det gäller att hämma aktiviteterna av GFPT2 och GFPT1, vilket tyder på närvaron av en ny regleringsmekanism.
3. Dechiffrera den molekylära mekanismen för zinkjoner på aktiviteten av GFPT2 och GLMS enzym.
Forskarna isolerade homologen av GFPT2-proteinet från E. coli och fortsatte med en serie biokemiska experiment och kristallstrukturanalyser. Fynden avslöjade att GLMS-proteinet har förmågan att binda zinkjoner, och i synnerhet sker denna bindning nära den substratbindande regionen. Detta antyder ett potentiellt scenario där zinkjoner skulle kunna konkurrera om bindning vid det aktiva stället för GLMS och GFPT2, eller hindra aktiviteten hos båda enzymerna genom att bilda koordinationsbindningar med deras aktiva platser.

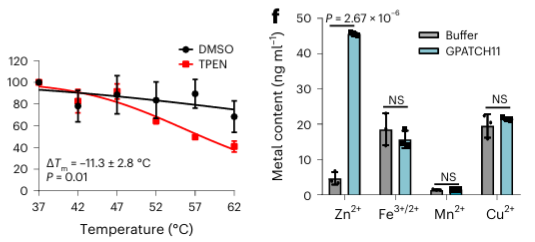
4. Metallkelatorn TPEN kan specifikt känna igen zinkjonbindande proteiner.
Slutligen utökade forskarna möjligheten hos METAL-TPP att identifiera metallbindande proteiner i mänskliga proteiner med hjälp av metallkelatorn TPEN. Experimentella resultat visade att bland de 150 proteinerna med reducerad termisk stabilitet var 110 (73%) kända metallbindande proteiner, vilket indikerar att TPEN, liksom EDTA, specifikt kan känna igen metallbindande proteiner. Bland dessa var 95 (86 %) av de kända metallbindande proteinerna zinkjonbindande proteiner, medan endast 41 % av proteinerna med reducerad termisk stabilitet orsakad av EDTA var zinkjonbindande proteiner, vilket tyder på att TPEN föredrar att identifiera zinkjoner. -bindande proteiner.
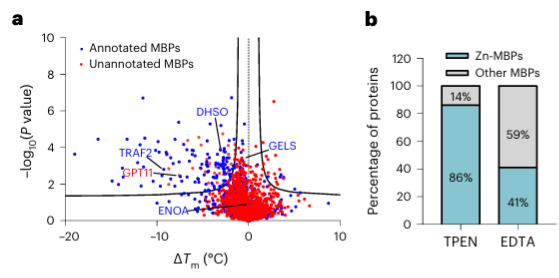
Bland de 40 potentiella metallbindande proteinerna som identifierats valde författarna ett målprotein, GPATCH11, för preliminär biokemisk validering och fann att detta protein är ett zinkjonbindande protein.
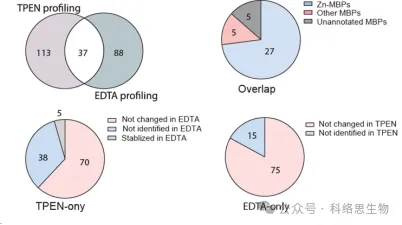
5. Jämförelse av igenkänningsförmågan hos två metallkelatorer i METAL-TPP.
Forskarna jämförde också förmågan hos två metallkelatorer, TPEN och EDTA, att identifiera proteiner med reducerad termisk stabilitet i METAL-TPP-proteomikdata. De fann att bland de 37 proteiner som identifierats av båda kelatorerna var 27 kända för att binda zink, 5 var kända för att binda andra metaller och 5 var tidigare omärkta som metallbindande proteiner. För proteiner vars termiska stabilitet minskade under en kelator och förblev oförändrad eller ökad under den andra, föreslog forskarna två möjliga orsaker till skillnaden i intervallet för identifiering av METAL-TPP. För det första kan varje kelator fungera som en bindande ligand i vissa proteiner, vilket gör dem mer stabila och motverkar den destabiliserande effekten som orsakas av metallbindning. För det andra, på grund av de olika molekylära strukturerna, har de två kelatorerna också mycket olika löslighet i vatten. Således kan framtida METAL-TPP-studier utföras med andra kelatorer med unika molekylära strukturer för att mer omfattande utforska omfattningen av metalloproteomen.
Sammantaget har denna studie introducerat en ny metod, METAL-TPP, som fungerar som ett potent verktyg för att utföra metallbindande proteomikundersökningar. Genom detta tillvägagångssätt identifierade forskare systematiskt metallbindande proteiner och klargjorde deras roller i biologiska funktioner och patogenes. Denna strävan upprättar inte bara viktiga databaser utan ger också värdefulla insikter för att förstå de biokemiska funktionerna och läkemedelsutvecklingspotentialen hos metallbindande proteiner, vilket främjar ytterligare forskning inom relaterade områden.
Hänvisning:,https://www.nature.com/articles/s41589-024-01563-y.

