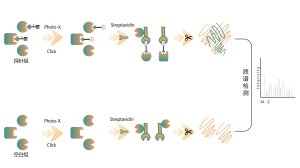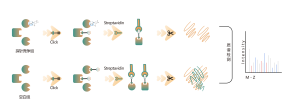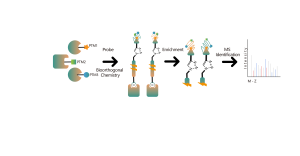Produkter
Identifiering av icke-kovalenta små molekylbindande fickor i celler
Plattformens tekniska funktioner
Det är avgörande att bestämma bindningssättet mellan småmolekylära läkemedel och deras proteinmål för läkemedels-FoU. En omfattande analys av dessa interaktioner på både strukturella och fysikalisk-kemiska nivåer kan avsevärt fördjupa vår förståelse av proteinfunktioner och underlätta läkemedelsdesign och optimering. Strukturbiologiska tekniker, inklusive röntgen, kryo-elektronmikroskopi (kryo-EM), kärnmagnetisk resonans (NMR), etc., har använts i stor utsträckning vid bestämning av läkemedelsbindningssätt. De högupplösta strukturerna av protein-läkemedelskomplex kan i hög grad gynna optimeringen av läkemedelsstrukturer i ett tidigt skede. Proteinstrukturanalys har dock konsekvent inneburit utmaningar inom biovetenskaplig forskning, särskilt för membranproteinmål som G-proteinkopplade receptorer (GPCR) och jonkanalproteiner. Det förbrukar ofta avsevärd tid och resurser på processer som proteinrening, screening för protein-läkemedelskomplexkristallisering och datainsamling och bearbetning.
En idealisk metod är att identifiera protein-läkemedelsinteraktionslägen inom levande celler. Detta tillvägagångssätt undviker inte bara höga kostnader förknippade med strukturella studier, utan eliminerar också möjliga falska positiva resultat från konstgjorda tillstånd som buffertar med hög salthalt eller mättade läkemedel.

Arbetsflöde

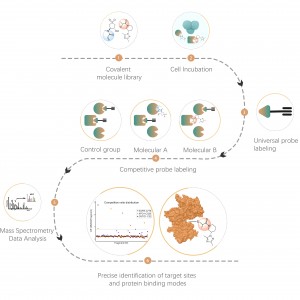
ChomiX använder kemiska prober för fotoaffinitet som härrör från de icke-kovalenta småmolekylära läkemedlen, vilket möjliggör infångning av märkta peptider som finns i bindningsfickor från levande celler och efterföljande identifiering med masspektrometri. När väl peptidsekvenser och märkta ställen har bestämts kunde det exakta bindningssättet snabbt erhållas med hjälp av molekylär dockning.
Tekniska fördelar

Fallstudie
Projektmål
Det förmodade målet för läkemedel B är ett transmembranprotein med flera rapporterade läkemedelsbindande fickor. Strukturella biologiska metoder som röntgen och kryo-EM misslyckades. Den kemoproteomiska strategin kommer att prövas för att få fram bindningsläget i levande celler.
Experimentell metod
Fotoaffinitetsproben B som innehåller de fototvärbindande och bioortogonala delarna designades och syntetiserades. Målengagemang av läkemedel B bekräftades först och den märkta peptiden som finns i bindningsfickan sekvenserades av MS.
Datavisualisering

Immunoblot och MS-baserade kemoproteomiska data visade att läkemedelskandidaten effektivt kan konkurrera om den sondmärkta signalen, vilket indikerar direkt bindning av läkemedelskandidaten till målproteinet i levande celler.

MS/MS-spektrum för läkemedelsmodifieringspeptid: CLPFIIGCNPTILH*VHELYIR

Läkemedelsbindningsläge baserat på MS-baserade kemoproteomiska data och molekylär dockning