Avslöjar mysteriet med den lilla molekylen WA: kastar ljus över PHGDH-enzymreglering och banar väg för nya anti-cancerterapier
Serin, en oumbärlig aminosyra, fyller olika avgörande biologiska funktioner i levande organismer. Det fungerar inte bara som en grundläggande komponent i proteinsyntesen utan deltar också i regleringen av många metabola vägar, inklusive nukleotidsyntes, metioninmetabolism och antioxidantfunktioner. Bland dessa vägar har fosfopyruvatdehydrogenas (PHGDH) avgörande betydelse eftersom det katalyserar det inledande steget av serinsyntesvägen och omvandlar 3-fosfoglycerat till 3-fosfohydroxipyruvat. Med tanke på dess centrala roll i serinmetabolism är varje avvikelse i PHGDH-funktionen intrikat kopplad till uppkomsten och progressionen av många sjukdomar, särskilt cancer.
Den här artikeln introducerar ett innovativt tillvägagångssätt som använder kemisk proteomik och fenotypiska analystekniker för att identifiera en förening som kan kovalent hämma PHGDH. Medan de flesta PHGDH-hämmare vanligtvis är konkurrenskraftiga till sin natur, presenterar författarna Withangulatin A (WA), en naturlig liten molekyl, som en ny kovalent hämmare av PHGDH. WA framstår som en lovande ledande förening för utveckling av PHGDH-hämmare. Dessutom fungerar WA som en värdefull sond för att undersöka funktionaliteten av PHGDH och serinsyntesvägen (SSP). Med hjälp av denna hämmare får forskarna djupare insikter i de reglerande mekanismerna som styr serinmetabolism, och öppnar därmed vägar för att utforska potentiella behandlingsmetoder för relaterade sjukdomar, särskilt cancer.
Denna upptäckt ger inte bara lovande riktningar för utvecklingen av nya läkemedelsbehandlingsstrategier utan ger också avgörande insikter om serinmetabolismens roll i sjukdomsprogression.
Forskningsväg
Experimentell process
1. Jämförelse av WP och WA i cytotoxicitetsexperimenten.
I studien utarbetade och syntetiserade författaren en sammansatt sond som kallas WP. Genom att använda humana koloncancerceller (HCT-116) och normala kolonceller (NCM460), observerade författarna att WP uppvisade jämförbar cytotoxicitet som WA. Detta tyder på att införandet av alkynmarkörer inte signifikant förändrade dess cytotoxiska effekter. Dessutom noterade författarna att WA visade lägre cytotoxicitet i normala tjocktarmsceller men högre cytotoxicitet i tjocktarmscancerceller, vilket understryker dess förbättrade selektivitet mot tjocktarmscancerceller.
Därefter använde författarna en aktivitetsbaserad proteinprofileringsstrategi (ABPP), med användning av WP-sonden i HCT-116-celler. Detta tillvägagångssätt ledde till identifieringen av PHGDH som ett direkt målprotein för WA. Experimentell validering utfördes med hjälp av WB-pull down-analyser, vilket bekräftar resultaten.
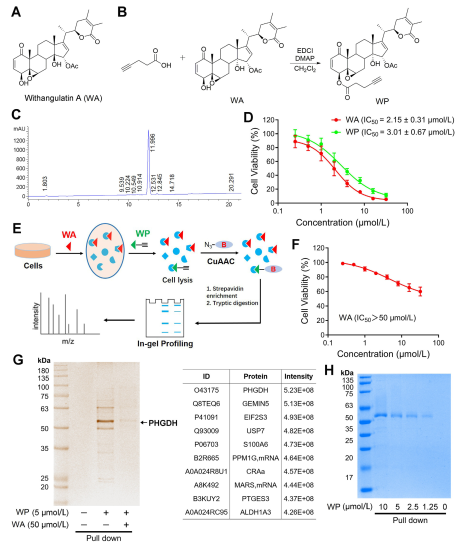
Figur 1: Chemical Proteomics Approach för att identifiera mål för Withangulatin A.
2. Bekräftelse av direkt interaktion mellan WA och PHGDH.
Genom att använda Activity-Based Protein Profiling-teknologi (ABPP) identifierade författarna PHGDH som ett direkt mål för förening WA i HCT-116-celler. För att validera interaktionen mellan WA och PHGDH genomförde författarna experiment med DARTS (Drug Affinity Responsive Target Stability) och Cellular Thermal Shift Assay (CETSA). Resultaten visade att WA ökade den termiska stabiliteten för PHGDH och signifikant hämmade dess aktivitet. Vidare gav Biolayer Interferometry (BLI) experiment ytterligare bekräftelse på den direkta interaktionen mellan WA och PHGDH.
Författarna undersökte också den irreversibla naturen hos WA-bindning till PHGDH. Deras experiment visade att PHGDH förhindrade WP-bindning; dock kan förinkubation med lösningar innehållande N-acetylcystein (NAC) eller glutation (GSH) reversera bindningen av WP till PHGDH. Dessa fynd tyder på en irreversibel kovalent bindning mellan WA och cysteinrester i PHGDH-proteinet.
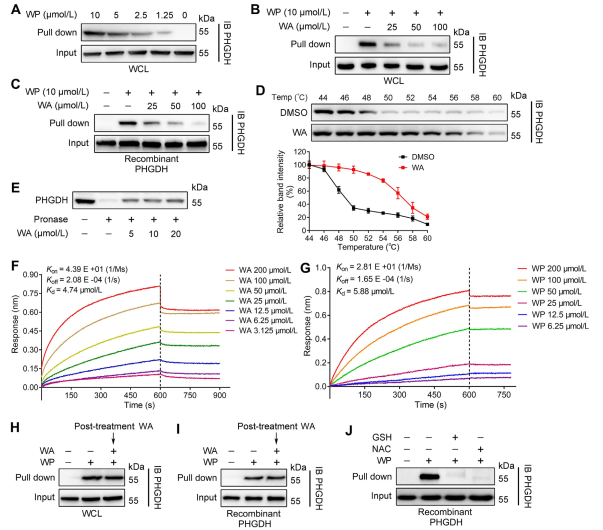
Figur 2: WA binder direkt till PHGDH.
3. WA binder kovalent till PHGDH via den a-p-omättade ketondelen.
För att ytterligare belysa mekanismen genom vilken WA interagerar med PHGDH, utförde utredarna experiment för att bekräfta den kovalenta bindningen av WA till PHGDH genom dess α-β-omättade ketonstruktur. Initialt reducerades WA:s a,β-omättade ketonfragment för att producera WA-1 (se del Figur 3A). Efterföljande analyser med användning av Cell Counting Kit-8 (CCK-8)-analyser och Pull-down-proteininteraktionsanalyser (se figur 3B) visade att WA:s cytotoxiska effekt verkligen var beroende av dess a- och β-omättade ketonstruktur. Omvänt misslyckades WA-1 med att effektivt förhindra bindningen av PHGDH till WP (se figur 3C och D), vilket ytterligare bekräftade den kovalenta bindningen av den β-omättade ketonen till PHGDH (se figur 3E).
Med tanke på den betydande rollen av PHGDH-hämning eller frånvaro i blockerande serinsyntesvägar (SSP)-processer i tumörceller, fortsatte författarna att undersöka effekten av WA på SSP-aktivitet i HCT-116-celler med hjälp av U-13C-glukosstabil isotopmärkning (se till figur 3J). Experimentella resultat avslöjade att WA effektivt hämmade SSP-aktivitet i HCT-116-celler.
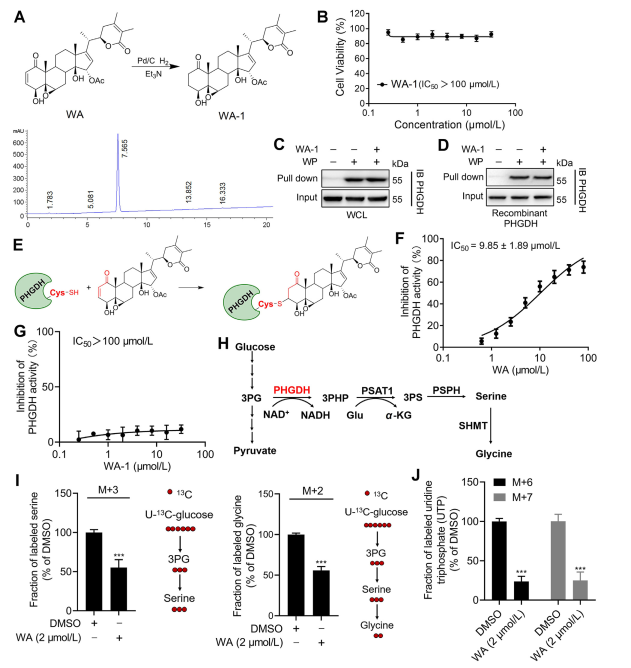
Figur 3: WA binder kovalent till PHGDH och hämmar PHGDH-aktivitet.
4. Cys295-resten av PHGDH är kovalent bunden till WA.
Teoretiskt kan de a- och p-omättade ketondelarna i WA bilda en kovalent bindning med cysteinrester i proteinet. Faktum är att författarna observerade kovalent modifiering av Cys295-resterna i PHGDH av WA. Därefter tillhandahöll de ytterligare bevis för WA:s kovalenta bindning till Cys295-resterna av PHGDH och visade att mutationer vid Cys295 signifikant minskade WA:s hämmande aktivitet på PHGDH. Dessutom visade Biolayer Interferometry (BLI)-experiment ingen interaktion mellan WA och rekombinant Cys295A PHGDH-protein, vilket bekräftar den selektiva kovalenta bindningen av WA till PHGDH.
Dessutom indikerade simuleringar av molekylär dynamik att WA fungerar som en allosterisk regulator av PHGDH, med Cys295-resten som potentiellt fungerar som en ny allosterisk plats för PHGDH.
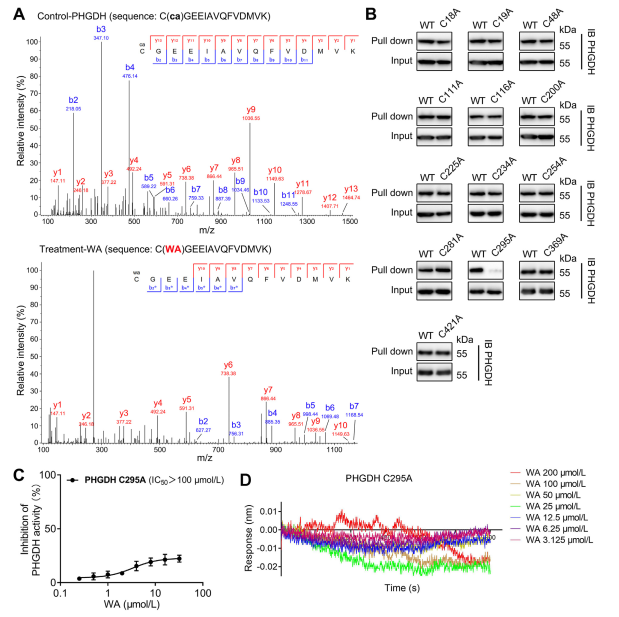
Figur 4. WA binder selektivt kovalent till Cys295-resterna av PHGDH.
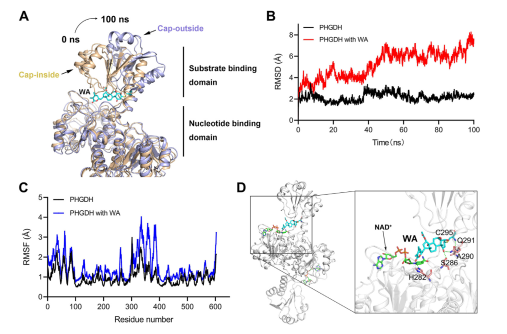
Figur 5: Cys295-rest som den allosteriska regleringsplatsen för PHGDH
5. Effekten av WA på redoxbalansen i HCT-116-celler.
Serinsyntesvägen (SSP) spelar en avgörande roll för att upprätthålla cellulär redoxbalans genom att tillhandahålla prekursorer för syntes av glutation (GSH) och NADPH-produktion, som är avgörande för redoxreaktioner. Författarna undersökte effekten av WA på redoxbalansen i HCT-116-celler och observerade att WA ledde till ökade nivåer av reaktiva syrearter (ROS), vilket följaktligen minskade GSH/GSSG- och NADPH/NADP+-förhållandena, vilket tyder på förhöjd oxidativ stress.
Western blot-analys avslöjade förhöjt uttryck av γ H2AX, klyvt kaspas3 och klyvt PARP, tillsammans med minskat uttryck av CHK2 och cyklin D1, vilket tyder på induktion av apoptos av WA. Dessutom resulterade förlust av PHGDH i ökad ROS-produktion, hämmade proliferation av HCT-116-celler och minskad cytotoxicitet av WA i celler med lågt PHGDH-uttryck. Dessa fynd understryker rollen av PHGDH i ROS-produktion och WA-medierad cytotoxicitet i HCT-116-celler.
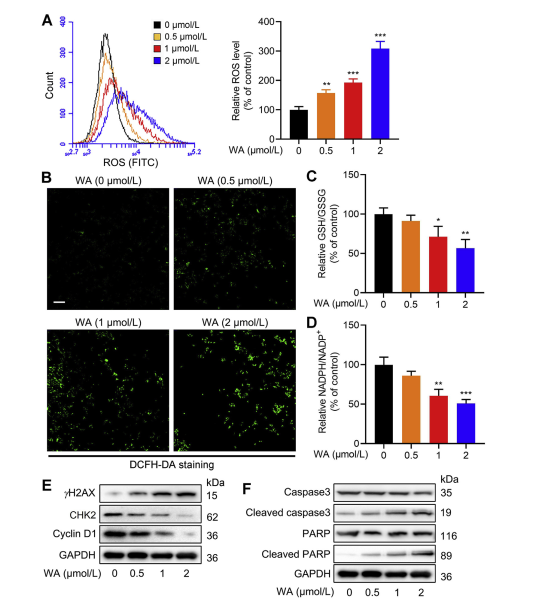
Figur 6: WA ökar intracellulära ROS-nivåer i HCT-116-celler
6. Cellproliferationseffekt i xenograftmodeller.
För att bedöma effekten av WA på proliferationen av HCT-116-celler in vivo, etablerade författarna en xenograftmodell med hjälp av HCT-116-celler. Resultaten visade att WA inte uppvisade några signifikanta effekter på kroppsvikt eller organmorfologi, vilket tyder på låg toxicitet.
För att ytterligare undersöka WA:s selektivitet för PHGDH-hämning, genererade författarna en xenograftmodell med användning av PHGDH knockout (KO) HCT116-celler. I denna modell inhiberade frånvaron av PHGDH markant HCT-116-cellproliferation (se figur 7, AC). Dessutom reducerades uttrycket av Ki67, en markör för cellproliferation, signifikant i PHGDH KO HCT116-cellxenotransplantatmodellen (se figur 7, D).
Noterbart, i xenotransplantatmodellen med användning av PHGDH KO HCT-116-celler, visade WA ingen signifikant hämmande effekt på cellproliferation (se figur 7, EG), vilket ytterligare bekräftar att den hämmande effekten av WA på HCT-116-celler berodde på PHGDH.
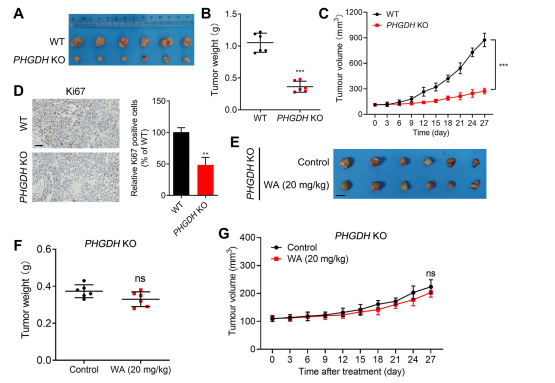
Figur 7: Effekt av WA på proliferationen av PHGDH KO HCT-116-celler in vivo
Resultaten av denna studie ger inte bara viktiga ledtrådar för den framtida utvecklingen av läkemedel mot cancer för PHGDH, utan ger också nytt hopp och potential för den nya läkemedelsutvecklingen inom cancerterapiområdet.
Hänvisning:https://doi.org/10.1016/j.apsb.2021.06.008

