【國家重點計畫】解開金屬結合蛋白:METAL-TPP突破與藥物發現創新
金屬結合蛋白是與金屬離子形成穩定複合物的關鍵成分,在生物體中發揮各種重要功能,包括細胞訊號傳導、催化生化反應和維持金屬離子穩態。它們的失調與癌症、神經系統疾病和代謝疾病等疾病有關。了解它們在疾病發病機制中的作用對於診斷和治療至關重要。此外,金屬結合蛋白是藥物開發中的重要靶點,因為許多藥物與它們相互作用以發揮治療作用。在這項研究中,研究人員引入了 METAL-TPP,這是一種最先進的化學蛋白質體學方法。 METAL-TPP 將熱穩定性定量蛋白質體分析 (TPP) 與金屬結合蛋白鑑定相結合,能夠有效且準確地檢測金屬結合蛋白。值得注意的是,它使用一系列金屬螯合劑來調節蛋白質的熱穩定性,促進純蛋白質和細胞裂解物的精確鑑定。這種創新方法為金屬結合蛋白的功能和機制提供了新的見解,有助於生物學研究、疾病理解和藥物開發。科樂西生物在藥物研發上提供先進的ABPP、TPP等技術服務,支援研究人員探索藥物機制、推廣新藥研發進程。

實驗過程
1. 使用 METAL-TPP 鑑定了 17 種潛在的金屬結合蛋白。
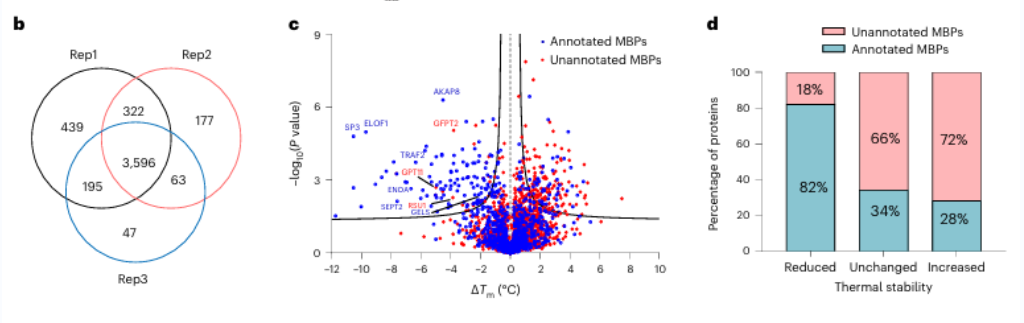
最初,研究人員評估了使用 EDTA 對純蛋白質和細胞裂解物進行廣譜金屬螯合的功效。他們觀察到 METAL-TPP 有效檢測金屬結合蛋白熱穩定性的降低。隨後,使用 METAL-TPP 對人類來源的蛋白質進行了系統性分析,鑑定出 125 種表現出熱穩定性下降的蛋白質。其中,102 種是先前已知的金屬結合蛋白。此外,還發現了 17 種未經事先功能註釋的潛在金屬結合蛋白,為金屬結合蛋白的作用提供了新的見解。
2.鋅離子對潛在金屬結合蛋白GFPT2的影響。
在這17種潛在的金屬結合蛋白中,研究人員選擇對蛋白GFPT2進行深入的生化驗證。 GFPT1/2 是己糖生物合成途徑中的第一個限速酶,有助於產生一種稱為 UDP-GlcNAc 的物質。研究人員在細胞層面證實,鋅離子與 GFPT2 相互作用,抑制其活性。此外,他們觀察到鋅離子的存在導致 UDP-GlcNAc 水平顯著降低,表明鋅離子透過抑制 GFPT2 的活性來調節己糖生物合成途徑。有趣的是,鋅離子在抑制 GFPT2 和 GFPT1 活性方面表現出不同的選擇性,顯示存在一種新的調節機制。
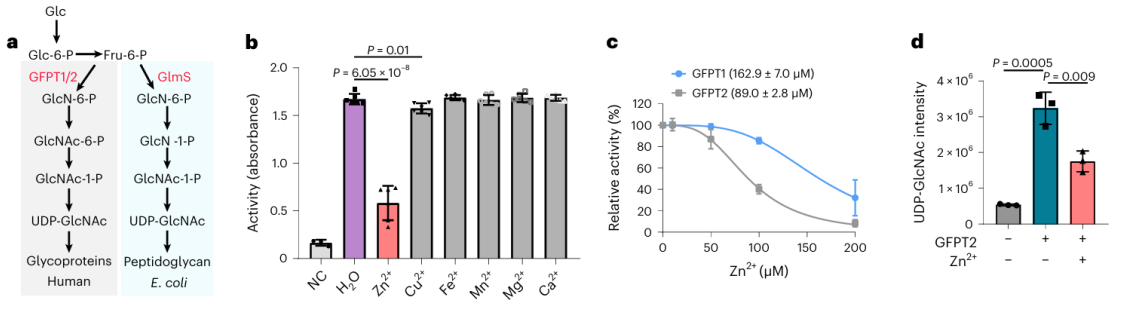
3. 破解鋅離子對GFPT2和GLMS酶活性的分子機制。
研究人員從大腸桿菌中分離出了GFPT2蛋白的同源物,並進行了一系列生化實驗和晶體結構分析。研究結果表明,GLMS 蛋白具有結合鋅離子的能力,值得注意的是,這種結合發生在底物結合區域附近。這表明鋅離子可能會競爭在 GLMS 和 GFPT2 活性位點上的結合,或透過與兩種酵素的活性位點形成配位鍵來阻礙這兩種酵素的活性。

4.金屬螯合劑TPEN可以特異性辨識鋅離子結合蛋白。
最後,研究人員使用金屬螯合劑 TPEN 擴展了 METAL-TPP 來辨識人類蛋白質中金屬結合蛋白的能力。實驗結果顯示,在150個熱穩定性降低的蛋白質中,有110個(73%)是已知的金屬結合蛋白,這顯示TPEN和EDTA一樣,可以特異性辨識金屬結合蛋白。其中,已知的金屬結合蛋白中有 95 個(86%)是鋅離子結合蛋白,而 EDTA 導致熱穩定性降低的蛋白中只有 41% 是鋅離子結合蛋白,這表明 TPEN 更傾向於識別鋅離子-結合蛋白。
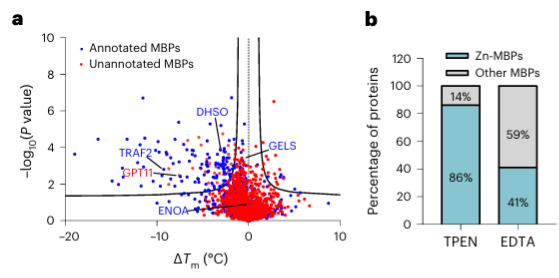
在鑑定出的 40 種潛在金屬結合蛋白中,作者選擇了一個目標蛋白 GPATCH11 進行初步生化驗證,發現該蛋白是一種鋅離子結合蛋白。
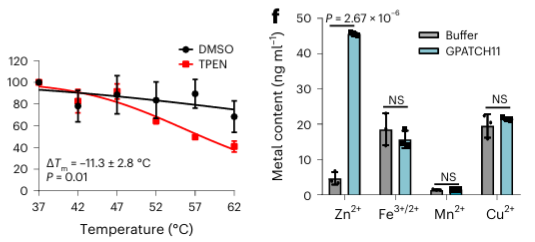
5.兩種金屬螯合劑在METAL-TPP中的辨識能力比較。
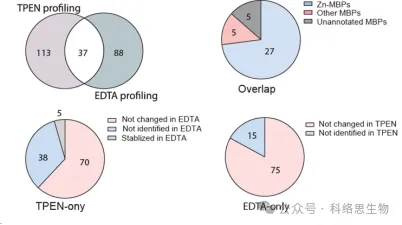
研究人員還比較了兩種金屬螯合劑 TPEN 和 EDTA 在 METAL-TPP 蛋白質組數據中識別熱穩定性降低的蛋白質的能力。他們發現,在這兩種螯合劑辨識的 37 種蛋白質中,27 種已知與鋅結合,5 種已知與其他金屬結合,還有 5 種先前未被註釋為金屬結合蛋白。對於熱穩定性在一種螯合劑下降低而在另一種螯合劑下保持不變或增加的蛋白質,研究人員提出了 METAL-TPP 識別範圍差異的兩個可能原因。首先,每種螯合劑都可以充當某些蛋白質中的結合配體,使它們更加穩定並抵消金屬結合引起的不穩定效應。其次,由於分子結構的不同,兩種螯合劑在水中的溶解度也有很大差異。因此,未來的 METAL-TPP 研究可以使用其他具有獨特分子結構的螯合劑進行,以更全面地探索金屬蛋白質組的範圍。
總的來說,這項研究引入了一種新方法 METAL-TPP,它是進行金屬結合蛋白質體學研究的有效工具。透過這種方法,研究人員系統地鑑定了金屬結合蛋白,並闡明了它們在生物功能和發病機制中的作用。這項工作不僅建立了重要的資料庫,也為了解金屬結合蛋白的生化功能和藥物開發潛力提供了寶貴的見解,從而促進了相關領域的進一步研究。

