揭開小分子 WA 的神秘面紗:揭示 PHGDH 酶調節並為新型抗癌療法鋪平道路
絲胺酸是一種不可或缺的胺基酸,在生物體內扮演各種重要的生物學功能。它不僅是蛋白質合成的基本成分,還參與多種代謝途徑的調節,包括核苷酸合成、甲硫胺酸代謝和抗氧化功能。在這些途徑中,磷酸丙酮酸脫氫酶 (PHGDH) 具有至關重要的意義,因為它催化絲胺酸合成途徑的第一步,將 3-磷酸甘油酸轉化為 3-磷酸羥基丙酮酸。鑑於其在絲胺酸代謝中的核心作用,PHGDH 功能的任何異常都與許多疾病(尤其是癌症)的發病和進展密切相關。
本文介紹了一種創新方法,利用化學蛋白質體學和表型分析技術來鑑定能夠共價抑制 PHGDH 的化合物。雖然大多數 PHGDH 抑制劑在本質上通常具有競爭性,但作者提出了 Withangulatorin A (WA)(天然小分子)作為 PHGDH 的新型共價抑制劑。 WA 成為開發 PHGDH 抑制劑的一種有前途的先導化合物。此外,WA 作為研究 PHGDH 和絲氨酸合成途徑 (SSP) 功能的有價值的探針。利用這種抑制劑,研究人員可以更深入地了解絲胺酸代謝的調節機制,從而為探索相關疾病(尤其是癌症)的潛在治療方式開闢途徑。
這項發現不僅為新型藥物治療策略的開發提供了一個有希望的方向,也為絲胺酸代謝在疾病進展中的作用提供了重要的見解。
研究路線
實驗過程
1. WP和WA在細胞毒性實驗的比較。
在這項研究中,作者設計並合成了一種稱為WP的複合探針。作者利用人類結腸癌細胞 (HCT-116) 和正常結腸細胞 (NCM460) 觀察到 WP 表現出與 WA 相當的細胞毒性。這顯示包含炔烴標記物並沒有顯著改變其細胞毒性作用。此外,作者指出,WA 在正常結腸細胞中表現出較低的細胞毒性,但在結腸癌細胞中表現出較高的細胞毒性,這強調了其對結腸癌細胞的選擇性增強。
隨後,作者採用了基於活性的蛋白質分析 (ABPP) 策略,在 HCT-116 細胞中利用 WP 探針。這種方法導致 PHGDH 被鑑定為 WA 的直接目標蛋白。使用 WB-pull down 測定進行實驗驗證,證實了研究結果。
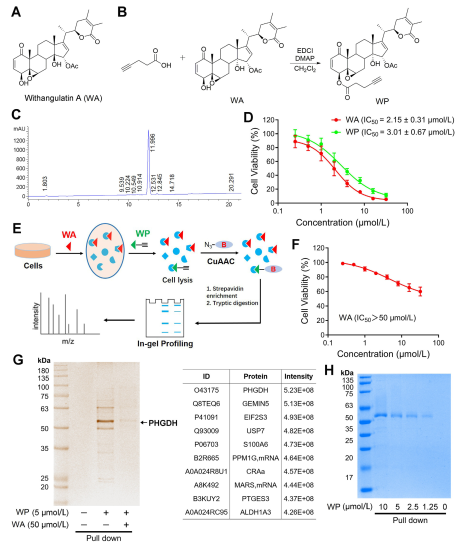
圖 1:確定 Withangulatetin A 標靶的化學蛋白質體學方法。
2. 確認 WA 與 PHGDH 之間的直接互動。
利用基於活性的蛋白質分析 (ABPP) 技術,作者確定 PHGDH 是 HCT-116 細胞中化合物 WA 的直接標靶。為了驗證 WA 和 PHGDH 之間的相互作用,作者進行了藥物親和力響應目標穩定性 (DARTS) 和細胞熱位移測定 (CETSA) 實驗。結果表明,WA增強了PHGDH的熱穩定性並顯著抑制其活性。此外,生物層干涉測量(BLI)實驗進一步證實了 WA 和 PHGDH 之間的直接相互作用。
作者也研究了 WA 與 PHGDH 結合的不可逆性質。他們的實驗表明,PHGDH 可以阻止 WP 結合;然而,用含有 N-乙醯半胱氨酸 (NAC) 或穀胱甘肽 (GSH) 的溶液預孵育可能會逆轉 WP 與 PHGDH 的結合。這些發現表明 WA 和 PHGDH 蛋白中的半胱氨酸殘基之間存在不可逆的共價結合。
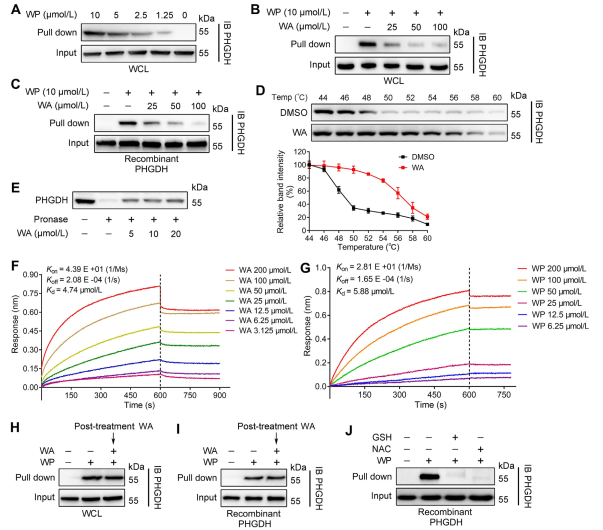
圖 2:WA 直接結合 PHGDH。
3. WA透過α-β-不飽和酮部分與PHGDH共價結合。
為了進一步闡明WA與PHGDH相互作用的機制,研究人員進行了實驗,證實WA透過其α-β-不飽和酮結構與PHGDH共價結合。最初,WA 的 α,β-不飽和酮片段被還原以產生 WA-1(參見部分圖 3A)。隨後使用細胞計數試劑盒-8 (CCK-8) 測定和 Pull-down 蛋白相互作用測定(參見圖 3B)進行的分析表明,WA 的細胞毒性作用確實依賴其 α 和 β-不飽和酮結構。相反,WA-1未能有效阻止PHGDH與WP的結合(參見圖3C和D),進一步證實了β-不飽和酮與PHGDH的共價結合(參見圖3E)。
鑑於 PHGDH 抑製或缺失在阻斷腫瘤細胞絲氨酸合成途徑 (SSP) 過程中的重要作用,作者繼續使用 U-13C-葡萄糖穩定同位素標記研究 WA 對 HCT-116 細胞中 SSP 活性的影響(參見圖3J )。實驗結果表明,WA有效抑制HCT-116細胞中的SSP活性。
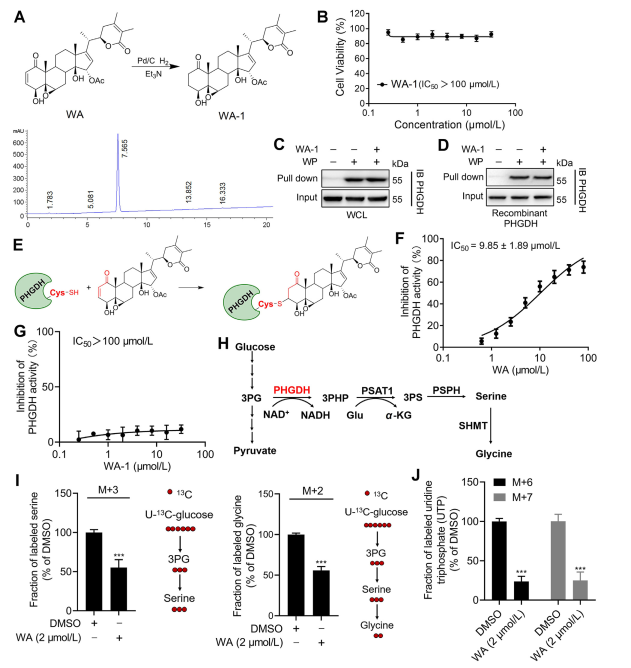
圖 3:WA 與 PHGDH 共價結合並抑制 PHGDH 活性。
4. PHGDH 的 Cys295 殘基與 WA 共價結合。
理論上,WA的α和β-不飽和酮部分可以與蛋白質的半胱胺酸殘基形成共價鍵。事實上,作者觀察到 WA 對 PHGDH 中 Cys295 殘基的共價修飾。隨後,他們提供了WA與PHGDH的Cys295殘基共價結合的進一步證據,並證明Cys295處的突變顯著降低了WA對PHGDH的抑制活性。此外,生物層干涉(BLI)實驗顯示WA和重組Cys295A PHGDH蛋白之間沒有相互作用,證實了WA與PHGDH的選擇性共價結合。
此外,分子動力學模擬表明,WA 作為 PHGDH 的變構調節劑發揮作用,其中 Cys295 殘基可能作為 PHGDH 的新型變構位點。
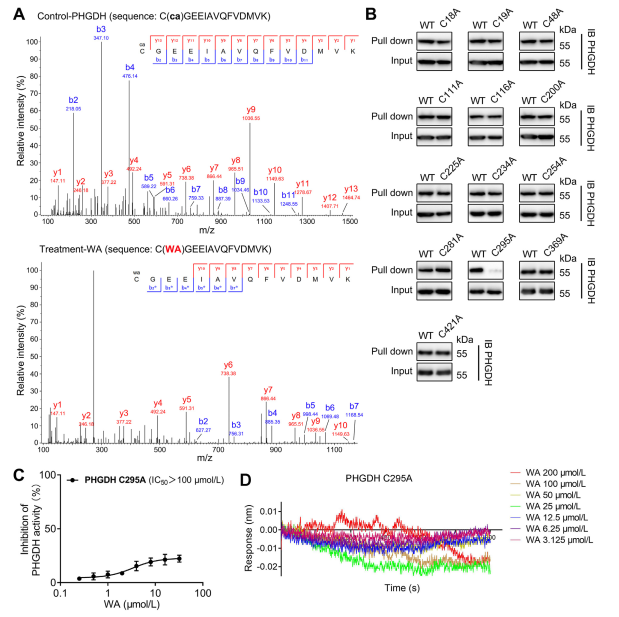
圖 4. WA 選擇性共價結合 PHGDH 的 Cys295 殘基。
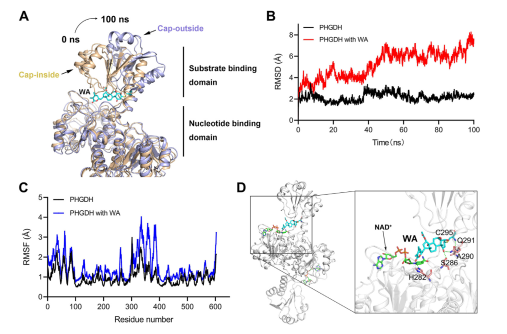
圖 5:Cys295 殘基作為 PHGDH 的變構調節位點
5. WA 對 HCT-116 細胞氧化還原平衡的影響。
絲氨酸合成途徑 (SSP) 透過提供氧化還原反應必需的穀胱甘肽 (GSH) 合成和 NADPH 產生的前體,在維持細胞氧化還原平衡方面發揮關鍵作用。作者研究了 WA 對 HCT-116 細胞氧化還原平衡的影響,並觀察到 WA 導致活性氧 (ROS) 水平增加,從而降低 GSH/GSSG 和 NADPH/NADP+ 比率,表明氧化壓力加劇。
Western blot 分析顯示 γ H2AX、Cleaved caspase3 和 cleaved PARP 表現升高,同時 CHK2 和細胞週期蛋白 D1 表現降低,顯示 WA 誘導細胞凋亡。此外,PHGDH 的缺失導致 ROS 產生增加,抑制 HCT-116 細胞的增殖,並降低 WA 在 PHGDH 表達低的細胞中的細胞毒性。這些發現強調了 PHGDH 在 HCT-116 細胞中 ROS 產生和 WA 介導的細胞毒性中的作用。
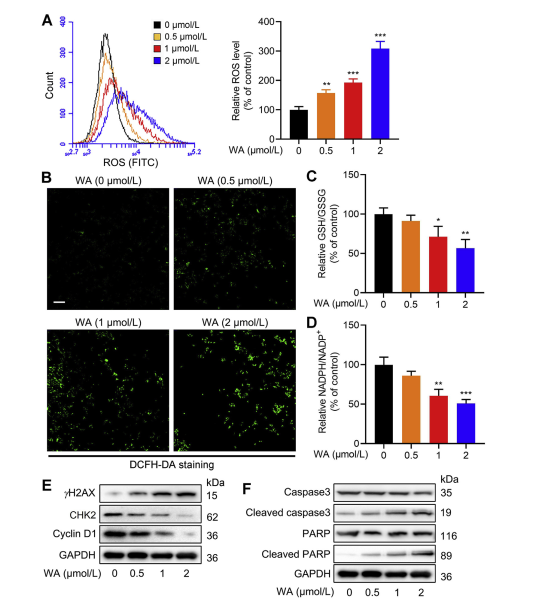
圖 6:WA 增加 HCT-116 細胞的細胞內 ROS 水平
6. 異種移植模型中的細胞增生效應。
為了評估 WA 對 HCT-116 細胞體內增殖的影響,作者使用 HCT-116 細胞建立了異種移植模型。結果表明,WA對體重或器官形態沒有顯著影響,表明毒性較低。
為了進一步研究 WA 對 PHGDH 抑制的選擇性,作者使用 PHGDH 敲除 (KO) HCT116 細胞產生了異種移植模型。在此模型中,PHGDH 的缺失顯著抑制 HCT-116 細胞增殖(參見圖 7,AC)。此外,在 PHGDH KO HCT116 細胞異種移植模型中,細胞增殖標記 Ki67 的表達顯著降低(參見圖 7,D)。
值得注意的是,在使用PHGDH KO HCT-116細胞的異種移植模型中,WA對細胞增殖沒有明顯的抑製作用(參見圖7,EG),進一步證實WA對HCT-116細胞的抑製作用依賴PHGDH 。
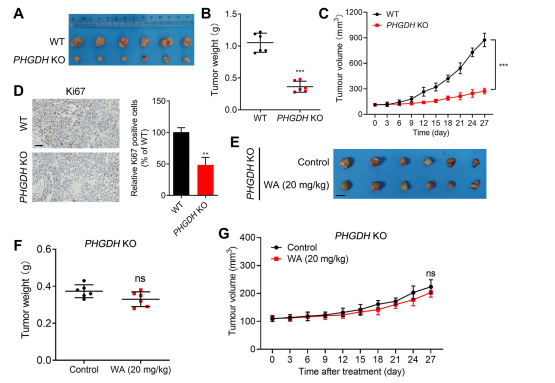
圖7:WA對體內PHGDH KO HCT-116細胞增生的影響
這項研究結果不僅為PHGDH的未來抗癌藥物開發提供了關鍵線索,也為癌症治療領域的新藥開發帶來了新的希望和潛力。

