利用化学蛋白质组学鉴定巨大戟二萜醇甲丁酸酯治疗光化性角化病的功能靶点 SLC25A20
这项研究利用化学蛋白质组学揭示了大分子丁酸甲酯 (Ing-Meb) 的新靶点,这是一种用于治疗日光性角化病的药物。研究团队最初设计并合成了一种名为Ing-Dayne的Ing-Meb光亲和探针,它在紫外光照射下与目标蛋白形成共价键,有助于识别潜在的功能靶点。通过随后的验证,作者确定 SLC25A20 是 Ing-Meb 的关键靶点。 SLC25A20 是一种参与脂肪酸代谢的线粒体膜结合肉碱-酰基肉碱转位酶。值得注意的是,Ing-Meb 对 SLC25A20 功能的抑制作用导致长链酰基肉碱的积累增加,证实 Ing-Meb 通过调节脂肪酸氧化途径来发挥其治疗作用。此外,该研究还深入探讨了结构修饰在天然产物研究中的重要性。通过对Ing-Meb进行结构修饰合成Ing-Dayne光亲和探针,研究人员成功发现了一个不同于常规理解的新靶点。这不仅增强了对 Ing-Meb 及其作用模式的理解,而且强调了结构修饰在化学蛋白质组学研究中对于揭示天然产物复杂性的关键作用。这些见解进一步推动药物创新,包括优化现有药物疗效、开发针对特定实体的新疗法以及阐明药物副作用机制。
研究路线
实验过程
1. 设计合成的 Ing-Dayne 光亲和探针揭示了光化性角化病药物 Ing-Meb 与其靶蛋白结合的机制。
在本研究中,使用了源自光化性角化病治疗药物 Ing-Meb 的 Ing 亲和探针 Ing-Dayne(参见图 1)。通过将该探针分子与特定细胞共培养并随后进行紫外光照射,探针内的双吖啶结构与细胞内蛋白质形成稳定的共价键。细胞裂解后,点击化学反应促进报告基团叠氮化物-四甲基罗丹明附着到目标蛋白上(如图 2 所示)。随后的 SDS-PAGE 分析(如图 3 所示)显示,Ing-Meb 对探针表现出显着的竞争性结合效应,而 Ingenol 具有相似的结构,没有表现出竞争性抑制。
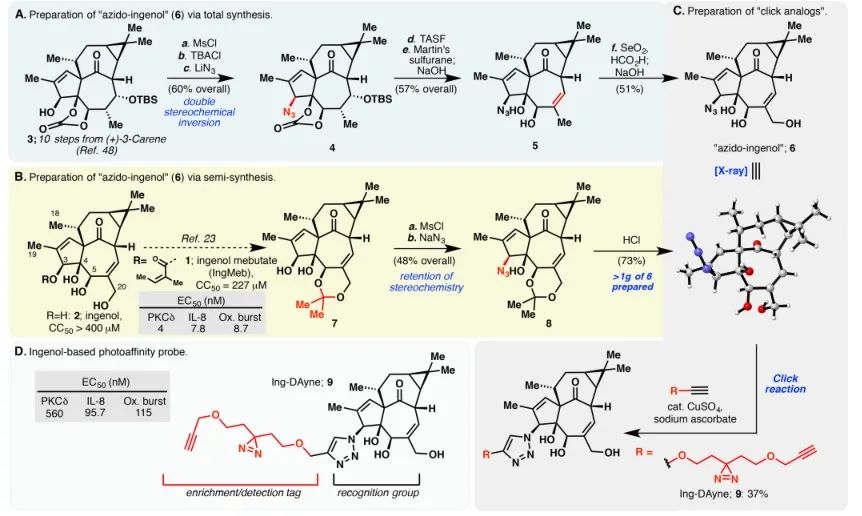
图 1:说明了 Ing-Dayne 合成所采用的两种合成路线。
2.新型探针11b鉴定了THP-1细胞内BBR的44个炎症相关靶蛋白,并揭示了EIF2AK2、eEF1A1、PRDX3和VPS4B是与BBR具有特异性相互作用的直接靶点。
作者通过一系列实验,成功地利用新型探针11b来标记和纯化THP-1细胞内的潜在靶蛋白。随后,他们利用 LC-MS/MS 分析鉴定了 44 种分子量范围为 20 至 80 kDa 的炎症相关蛋白,其中 6 种被发现可能在 BBR 的抗炎作用中发挥关键作用。进一步研究中,EIF2AK2、eEF1A1、PRDX3和VPS4B被证实是BBR的直接靶标,在高浓度BBR处理下表现出竞争性抑制作用。这一发现揭示了这些蛋白质和 BBR 之间可能存在的特定相互作用,从而阐明了它们在抗炎过程中与药物相互作用的新见解。
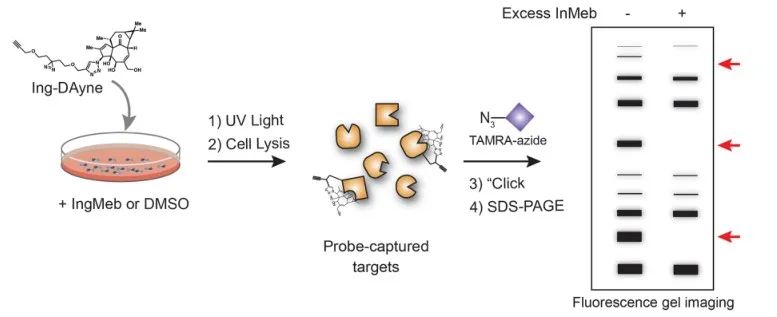
图 2:Ing-Dayne 靶点基于凝胶的验证过程。
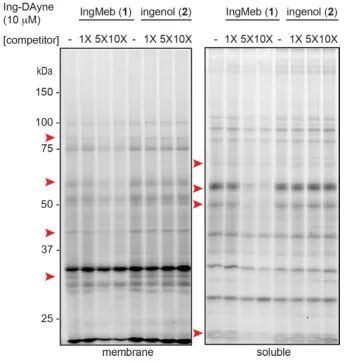
图 3:Ing-Meb 和巨大戟二萜醇对探针分子 Ing-Dayne 的竞争性抑制。
3. SILAC筛选结合Western blot验证,确定SLC25A20为Ingenol类药物Ing-Meb的主要靶点。
作者最初使用细胞培养氨基酸稳定同位素标记 (SILAC) 技术筛选了 28 种潜在靶蛋白(图 4)。随后,通过进一步的筛选和Western blot验证实验(图5),研究人员观察到,在这些候选靶点中,Ing-Meb对SLC25A20表现出最强的抑制作用,强烈表明SLC25A20是Ing-Meb的核心功能靶点之一。
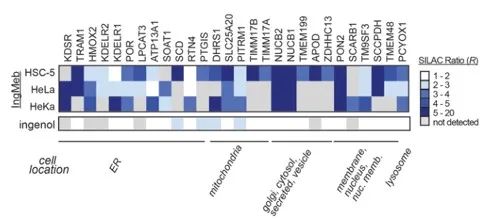
图4:初步筛选得到的28个潜在靶点。
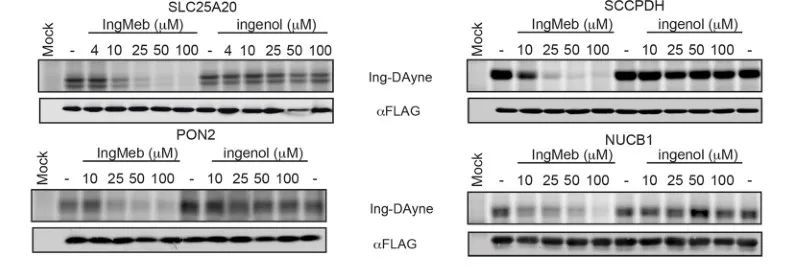
图 5:四种潜在靶蛋白的蛋白质印迹实验。
4. Ing-Meb 通过抑制 SLC25A20(一种线粒体膜蛋白,也称为肉毒杆菌碱脂酰转移酶)来调节脂肪酸氧化途径,从而揭示其作为光化性角化病药物的靶点。
作者研究了 SLC25A20,也称为肉毒碱硫辛酸转移酶或 CACT,是一种位于线粒体膜内的多模式整合膜蛋白。其主要功能涉及将长链酰基肉碱转运至线粒体,促进其与游离肉碱的交换。这些转运的酰基肉碱随后被肉碱棕榈酰转移酶-2 (CPT-2) 转化为脂肪酰基辅酶 A,从而作为脂肪酸 β-氧化的前体。实验结果表明,随着光化性角化病药物 Ing-Meb 浓度的增加,细胞长链酰基肉碱含量显着增加(如图 6 所示)。这一观察结果有力地支持了Ing-Meb对SLC25A20的抑制作用,从而证实SLC25A20是介导Ing-Meb作用的主要靶标之一。
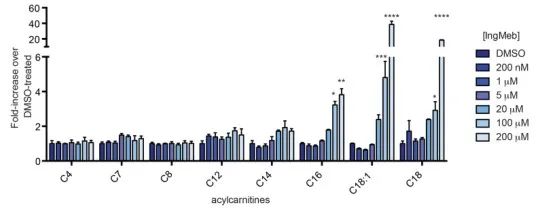
图 6:Ing-Meb 对长链酰基肉碱的影响
5.通过SLC25A20表达间接验证Ing-Meb细胞毒性作用:揭示其在药物活性调节中的靶功能。
研究人员试图将 HeLa 细胞中 SLC25A20 的抑制与 Ing-Meb 的潜在细胞毒性作用直接联系起来。结果表明,虽然 SLC25A20 的过表达并未改变这些细胞中 Ing-Meb 的半数抑制浓度,但值得注意的是,SLC25A20 表达的增加显着减轻了 Ing-Meb 对长链酰基肉碱积累的影响(如图 7 所示) 。这一结果进一步证实了 SLC25A20 作为 Ing-Meb 药物活性的关键功能靶点的假设。
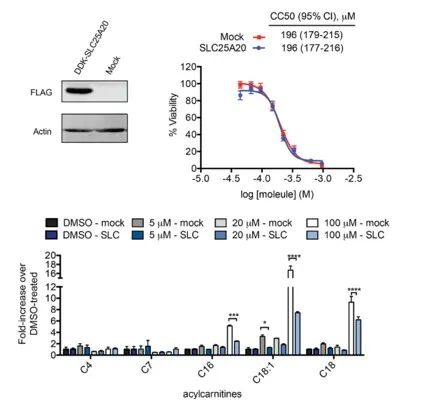
图7:SLC25A20表达与否对CC50和酰基肉碱的影响。
该研究不仅揭示了Ing-Meb的新靶点,也为结构复杂天然产物的靶点发现提供了新的理论基础和战略方向。参考:

