[高分突破]利用新型抑制剂 AJ 2-30 推进 SLC15A4 的抗炎调节:化学蛋白质组学方法(IF 14.8)
本文采用化学蛋白质组学设计和筛选一系列针对 SLC15A4 的新型抑制剂,SLC15A4 是一种在抗原呈递细胞中高度表达的关键炎症跨膜蛋白。潜在抑制剂的初始靶向利用了全功能化片段 (FFF) 探针库策略,在众多探针中将 FFF-21 鉴定为 IFN-α 产生的有效抑制剂。随后的结构优化导致了化合物 AJ 2-30 的开发,该化合物不仅表现出出色的抑制作用,而且证实了 SLC15A4 是其光交联后修饰的主要靶点。进一步研究表明,AJ 2-30 通过降低 SLC15A4 稳定性、诱导其通过溶酶体途径降解以及有效抑制 TLR 7-9 和 NOD 的激活来发挥有效的抗炎作用。该研究不仅成功开创了具有显着抗炎活性的SLC15A4抑制剂,而且为新型抗炎药物的开发铺平了道路。

研究路线
实验过程
1.用于筛选SLC15A4抑制剂的全功能化片段(FFF)探针库策略。
作者通过使用全功能化片段 (FFF) 探针库筛选 SLC15A4 抑制剂开始了他们的研究。该 FFF 包含两个组件:一个分子识别基团包含旨在靶向 SLC15A4 的片剂片段,另一个光交联的富集基团具有双吖啶和炔基团,用于可视化 SLC15A4。作者采用化学蛋白质组学工作流程,证实了该 FFF 探针库与细胞中的 SLC15A4 的结合,并评估了 FFF 探针是否可以减弱 TLR 9 刺激的细胞中的 IFN-α 水平。结果表明,在所有与 SLC15A4 结合的 FFF 探针中,FFF-21 表现出最高的抑制 IFN-α 水平的能力,其无标记类似物 FFF-21c 也表现出类似的抑制效果。
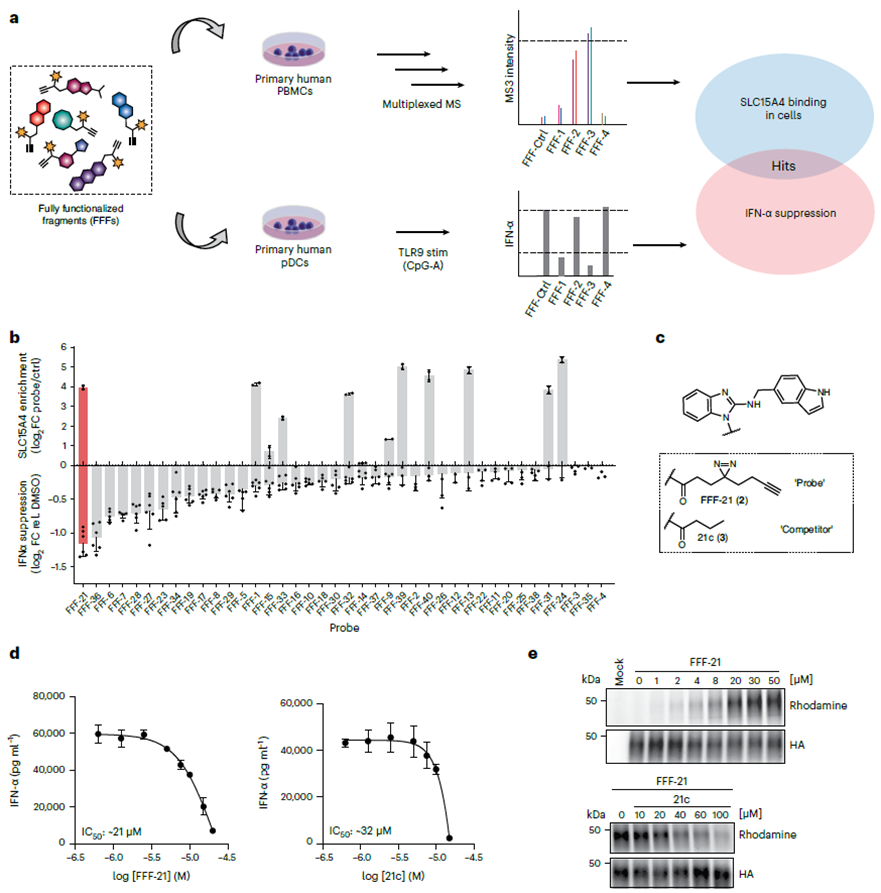
2. SLC15A4抑制剂的光交联修饰。
在初步选择化合物 FFF-21c 之后,作者继续优化其结构。通过合成 FFF-21c 的几种类似物,他们确定 AJ 2-30 是最有效的抑制剂。利用光交联技术,他们证实了它与目标的相互作用。随后,作者利用 ABPP 的直接标记方法和间接竞争方法,以及细胞热位移分析 (CETSA),最终确定 SLC15A4 作为 AJ 2-30 的主要靶标。
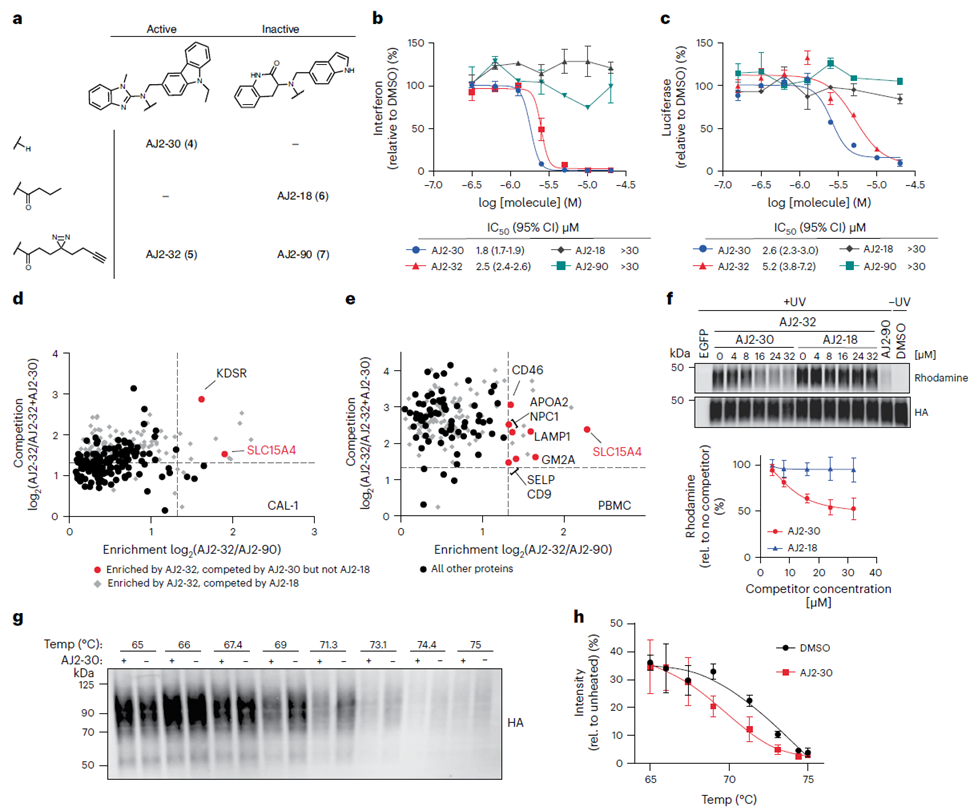
3.抗炎机制揭示AJ 2-30破坏SLC15A4稳定性。
在确认AJ 2-30与SLC15A4的结合及其抑制作用后,作者进行了一系列生化实验来阐明AJ 2-30的抗炎机制。结果显示,AJ 2-30 通过破坏 SLC15A4 蛋白的稳定性来诱导溶酶体介导的 SLC15A4 降解,从而以 SLC15A4 依赖性方式抑制免疫细胞中 TLR 7-9 和 NOD 的激活。这强调了 AJ 2-30 在治疗炎症和自身免疫性疾病方面的潜力。
总之,本研究巧妙地利用化学蛋白质组学技术来鉴定 AJ 2-30,一种具有显着抗炎活性的有效 SLC15A4 抑制剂。该化合物通过特异性靶向 SLC15A4 稳定性及其在抗原呈递和炎症信号通路中的作用,在动物模型中表现出显着的功效。这一关键进展不仅增强了我们对抗炎治疗靶点的理解,而且为未来开发治疗多种炎症和自身免疫性疾病的新型治疗药物奠定了坚实的基础。通过进一步的研究和临床验证,这些新型SLC15A4抑制剂有望为广大患者提供更精准、更有效的治疗选择,从而对全球健康产生深远影响。

