【国家重点项目】解开金属结合蛋白:METAL-TPP突破与药物发现创新
金属结合蛋白是与金属离子形成稳定复合物的关键成分,在生物体中发挥各种重要功能,包括细胞信号传导、催化生化反应和维持金属离子稳态。它们的失调与癌症、神经系统疾病和代谢疾病等疾病有关。了解它们在疾病发病机制中的作用对于诊断和治疗至关重要。此外,金属结合蛋白是药物开发中的重要靶点,因为许多药物与它们相互作用以发挥治疗作用。在这项研究中,研究人员引入了 METAL-TPP,一种最先进的化学蛋白质组学方法。 METAL-TPP 将热稳定性定量蛋白质组分析 (TPP) 与金属结合蛋白鉴定相结合,能够高效、准确地检测金属结合蛋白。值得注意的是,它使用一系列金属螯合剂调节蛋白质的热稳定性,促进纯蛋白质和细胞裂解物的精确鉴定。这种创新方法为金属结合蛋白的功能和机制提供了新的见解,有助于生物学研究、疾病理解和药物开发。科乐西生物在药物研发方面提供先进的ABPP、TPP等技术服务,支持研究人员探索药物机制、推进新药研发进程。

实验过程
1. 使用 METAL-TPP 鉴定了 17 种潜在的金属结合蛋白。
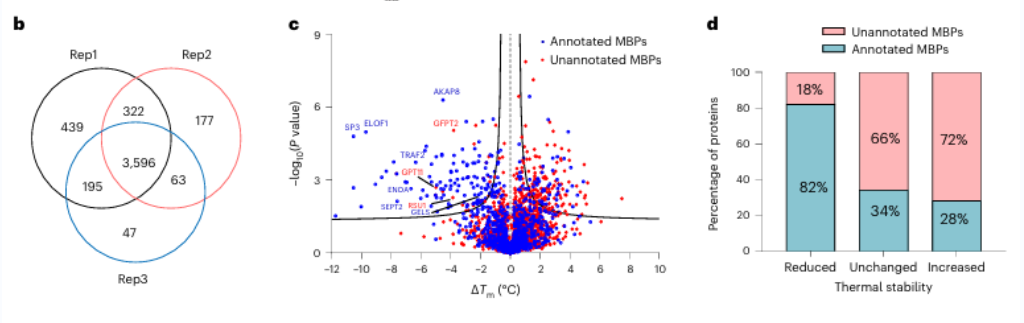
最初,研究人员评估了使用 EDTA 对纯蛋白质和细胞裂解物进行广谱金属螯合的功效。他们观察到 METAL-TPP 有效检测金属结合蛋白热稳定性的降低。随后,使用 METAL-TPP 对人类来源的蛋白质进行了系统分析,鉴定出 125 种表现出热稳定性下降的蛋白质。其中,102 种是先前已知的金属结合蛋白。此外,还发现了 17 种未经事先功能注释的潜在金属结合蛋白,为金属结合蛋白的作用提供了新的见解。
2.锌离子对潜在金属结合蛋白GFPT2的影响。
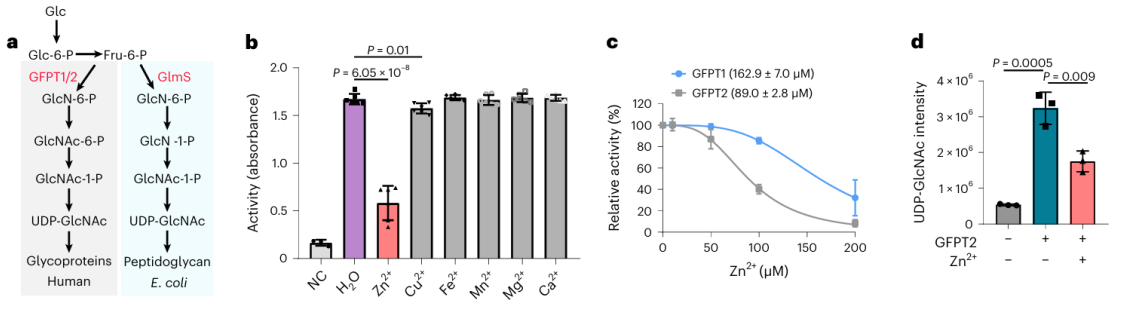
在这17种潜在的金属结合蛋白中,研究人员选择对蛋白GFPT2进行深入的生化验证。 GFPT1/2 是己糖生物合成途径中的第一个限速酶,有助于生成一种称为 UDP-GlcNAc 的物质。研究人员在细胞水平上证实,锌离子与 GFPT2 相互作用,抑制其活性。此外,他们观察到锌离子的存在导致 UDP-GlcNAc 水平显着降低,表明锌离子通过抑制 GFPT2 的活性来调节己糖生物合成途径。有趣的是,锌离子在抑制 GFPT2 和 GFPT1 活性方面表现出不同的选择性,表明存在一种新的调节机制。
3. 破译锌离子对GFPT2和GLMS酶活性的分子机制。
研究人员从大肠杆菌中分离出了GFPT2蛋白的同源物,并进行了一系列生化实验和晶体结构分析。研究结果表明,GLMS 蛋白具有结合锌离子的能力,值得注意的是,这种结合发生在底物结合区域附近。这表明锌离子可能会竞争在 GLMS 和 GFPT2 活性位点上的结合,或者通过与两种酶的活性位点形成配位键来阻碍这两种酶的活性。

4.金属螯合剂TPEN可以特异性识别锌离子结合蛋白。
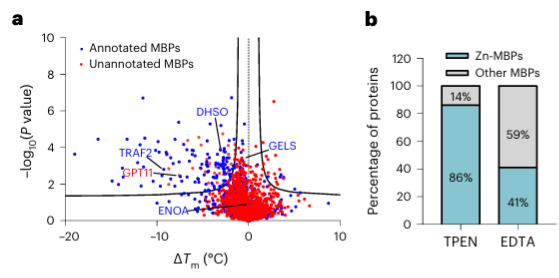
最后,研究人员使用金属螯合剂 TPEN 扩展了 METAL-TPP 识别人类蛋白质中金属结合蛋白的能力。实验结果显示,在150个热稳定性降低的蛋白质中,有110个(73%)是已知的金属结合蛋白,这表明TPEN和EDTA一样,可以特异性识别金属结合蛋白。其中,已知的金属结合蛋白中有 95 个(86%)是锌离子结合蛋白,而 EDTA 导致热稳定性降低的蛋白中只有 41% 是锌离子结合蛋白,这表明 TPEN 更倾向于识别锌离子-结合蛋白。
在鉴定出的 40 种潜在金属结合蛋白中,作者选择了一种目标蛋白 GPATCH11 进行初步生化验证,发现该蛋白是一种锌离子结合蛋白。
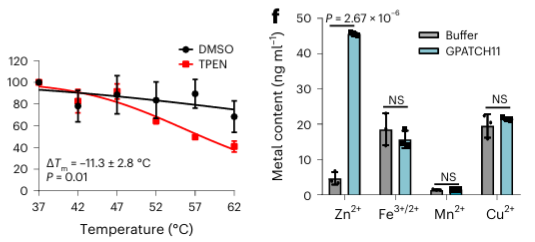
5.两种金属螯合剂在METAL-TPP中的识别能力比较。
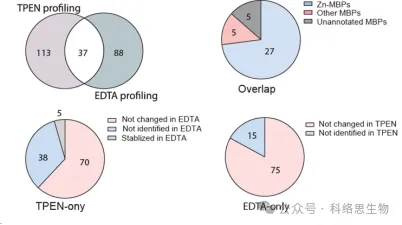
研究人员还比较了两种金属螯合剂 TPEN 和 EDTA 在 METAL-TPP 蛋白质组数据中识别热稳定性降低的蛋白质的能力。他们发现,在这两种螯合剂识别的 37 种蛋白质中,27 种已知与锌结合,5 种已知与其他金属结合,还有 5 种之前未被注释为金属结合蛋白。对于热稳定性在一种螯合剂下降低而在另一种螯合剂下保持不变或增加的蛋白质,研究人员提出了 METAL-TPP 识别范围差异的两个可能原因。首先,每种螯合剂都可以充当某些蛋白质中的结合配体,使它们更加稳定并抵消金属结合引起的不稳定效应。其次,由于分子结构的不同,两种螯合剂在水中的溶解度也有很大差异。因此,未来的 METAL-TPP 研究可以使用其他具有独特分子结构的螯合剂进行,以更全面地探索金属蛋白质组的范围。
总的来说,这项研究引入了一种新方法 METAL-TPP,它是进行金属结合蛋白质组学研究的有效工具。通过这种方法,研究人员系统地鉴定了金属结合蛋白,并阐明了它们在生物功能和发病机制中的作用。这项工作不仅建立了重要的数据库,而且为了解金属结合蛋白的生化功能和药物开发潜力提供了宝贵的见解,从而促进了相关领域的进一步研究。

