通过邻近标记策略揭示核酸-蛋白质相互作用:探索 G4PID 探针和 PLGPB 策略
本文介绍了一项创新研究,其中作者介绍了一种名为 G4PID 的新型双功能探针。该探针将 RHAU 的 G4 结合域 (RHAU23) 与 miniTurbo 生物素连接酶结合在一起,能够精确靶向 G 四链体 (G4) 并标记活细胞内的 G4 相互作用蛋白。 G4 结构由富含鸟嘌呤的核酸序列形成,在各种细胞过程中至关重要,包括基因调控、DNA 复制和修复。尽管人们广泛认识到 G4 的重要性,但细胞内的具体机制及其与蛋白质的相互作用仍然很大程度上未被探索。作者利用 G4PID,开发了一种专门的生物素标记方法 (PLGPB),以准确识别和分析 G4 相互作用蛋白,揭示 G4 结构在细胞功能中的关键作用。该方法成功鉴定了 149 个与 G4 相互作用的候选蛋白,主要参与转录调控、mRNA 剪接和染色质重塑。对七种候选蛋白的验证揭示了它们对 RNA G4 结合的偏好,尽管对 DNA G4 的亲和力不同。对剪接因子 SF3B4 的详细检查证明了它与 G4 结构的相互作用,影响选择性剪接事件。 G4 结构的稳定改变了 SF3B4 的结合效率并影响特定基因(例如 INPPL1 和 PPP6R2)的选择性剪接。

小檗碱是一种传统的生物碱,具有抗炎、降血糖、保护心血管等广泛的药理作用,引起了人们的广泛关注。然而,其精确的分子机制,特别是在炎症抑制方面,仍不清楚。
本研究利用 ABPP 技术填补了这一知识空白,将 EIF2AK2 识别为小檗碱发挥抗炎作用的关键靶点。该研究结果加深了我们对小檗碱作用机制的认识,为重新定位小檗碱和开发新型针对EIF2AK2的抗炎药物提供了科学依据。
该团队采用先进的化学蛋白质组学方法系统地研究小檗碱与细胞内蛋白质的相互作用,确认其与 EIF2AK2 的特异性结合及其酶活性的调节。这会影响炎症反应途径,有效抑制炎症进展。这一重大突破提供了对小檗碱抗炎机制的深入了解,并支持针对 EIF2AK2 的新型疗法的开发。
ChomiX 提供 ABPP 和 CETSA 等尖端服务,帮助研究人员探索药物机制并加快新药开发工作。
研究路线

实验过程
1. G4PID 探针的构建和特异性验证。
作者最初设计了 G4PID 探针,其中 G4 结合域 RHAU23 位于 N 末端,miniTurbo 位于 C 末端,通过柔性接头连接。使用BL21 (DE3)菌株进行表达和纯化。使用纯化的 G4PID 进行的特异性结合验证实验揭示了其与 BCL2 G4 的精确结合,显示出 15 ± 7 nM 的 Kd 值,同时对其他非 G4 结构显示出可忽略不计的亲和力。此外,作者评估了 G4PID 的生物素化特异性,证明了其选择性生物素化 G4 相互作用蛋白的能力。
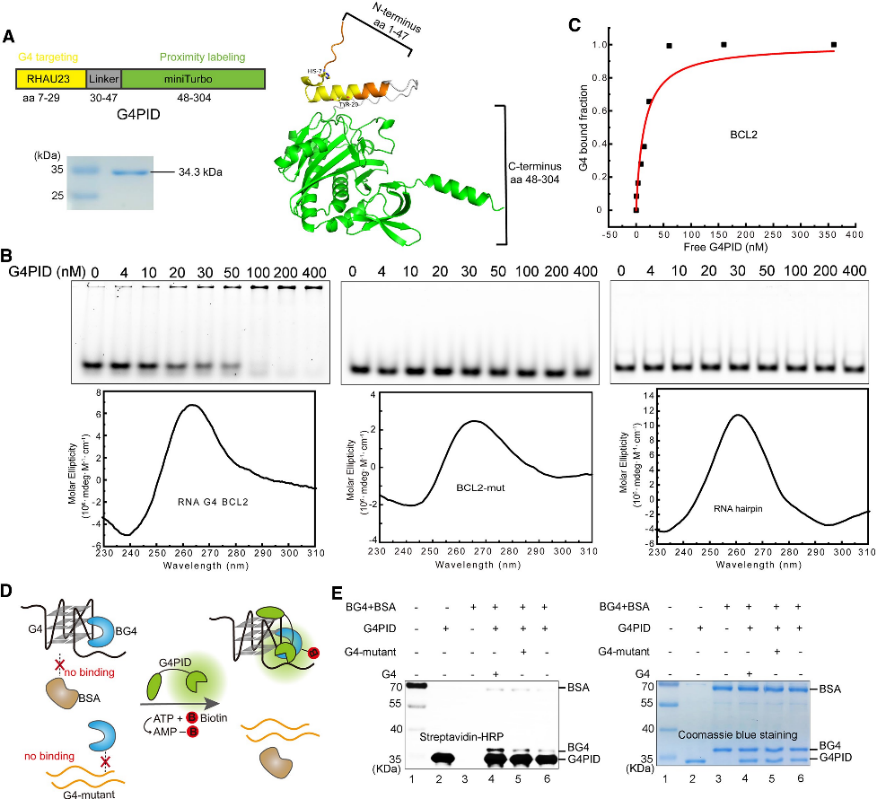
图1 G4 PID介导G 4相互作用蛋白的特异性生物素化
2. G4PID在细胞中的RNA G4结合能力和生物素标记特征。
作者建立了 HA-G4PID 和 HA-miniTurbo HeLa 细胞系,通过 eCLIP 实验研究 G4PID 与细胞内 RNA G4 的结合亲和力。结果证明 G4PID 与 RNA G4 选择性相互作用,与随机序列相比,对含有 PQS 的 RNA 序列表现出明显更高的结合亲和力。此外,作者观察到 G4PID 的独特特征有助于在细胞内启动生物素标记,而无需辅因子。这导致蛋白质标记效率显着提高,在 30 分钟内检测到 G4PID 的明显生物素化信号,表明与 miniTurbo 相比,标记动力学更快。
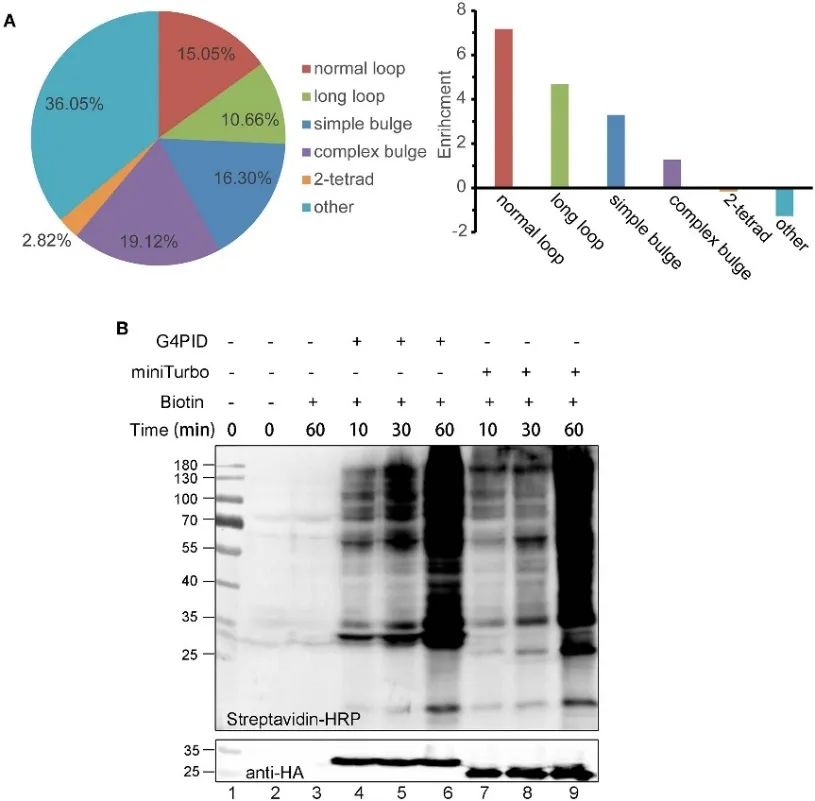
图2 G 4 PID结合RNA G4实验并优化HEK293T细胞中的标记效率。
3. 使用 PLGPB 方法捕获和检测细胞内 G4 相互作用蛋白质组。
随后,作者利用 G4PID 探针利用 G4 相互作用蛋白邻近标记 (PLGPB) 方法捕获和检测活细胞内的 G4 相互作用蛋白质组。在包含 578 个蛋白质的三个独立重复实验中,使用 G4PID 和 miniTurbo 转染 HEK293T 细胞,实现了 80% 的同一性。筛选揭示了 149 个与 G4 相互作用的候选蛋白,与现有的 G4 相互作用蛋白数据库存在显着重叠。此外,基因本体 (GO) 富集分析表明这些蛋白质与转录调控、mRNA 剪接和染色质重塑存在显着关联,这与 G4 研究的先前发现一致。
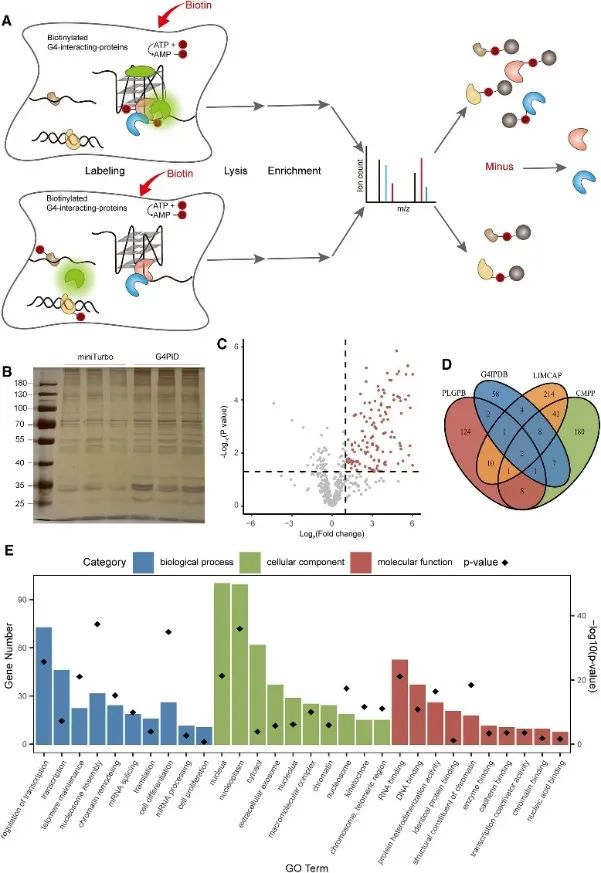
图3通过PLGPB方法鉴定了与G4相互作用的蛋白质。
4. 在新鉴定的候选者中验证 G4 结合亲和力。
通过 PLGPB 方法,作者发现了一系列涵盖各种功能类别的候选蛋白,包括常见的端粒相关蛋白、转录因子和相对不常见的蛋白结合蛋白。这表明 PLGPB 方法不仅重申了先前公认的 G4 相互作用蛋白,而且还通过发现跨越不同功能类别的新候选蛋白,显着拓宽了蛋白质领域。此外,作者验证了这些候选物与 RNA G4 和 DNA G4 的结合能力,揭示了对 RNA G4 的明显偏好以及对不同构象的 DNA G4 的亲和力的变化。这些发现强调了通过调节 G4 构象来调节蛋白质-G4 相互作用的潜力。
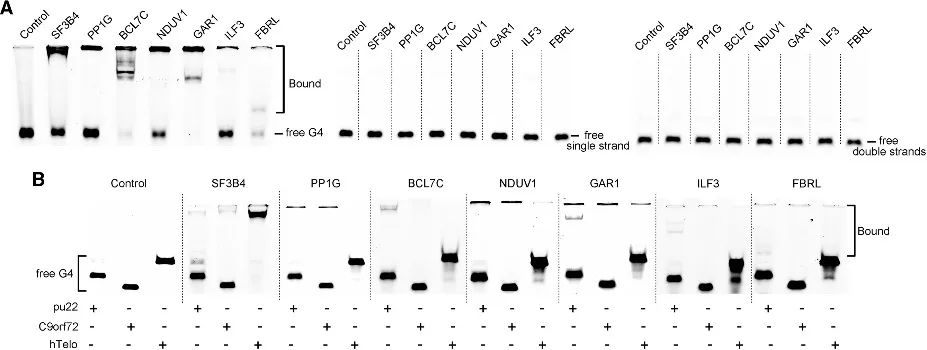
图 4 候选蛋白与 RNA G4 和 DNA G4 之间的相互作用。
5.确定SF3B4和G4结构的高可信度结合位点。
在研究 G4 结合的体内模式期间,作者发现了 SF3B4 蛋白的重要作用。 SF3B4 因其参与 RNA 剪接而闻名,通过 eCLIP 实验以及对 rG4-seq 和 DMS-seq 数据的综合分析,确定了其高可信度结合位点。这些结合位点中大约有一半含有 PQS,主要与非常规 G4 结构相关。此外,作者观察到 SF3B4 结合位点和 RNA PQS 之间存在密切的空间关系,主要在内含子区域内富集分布,特别是靠近 3' 剪接位点。这些发现强烈表明 SF3B4 和 G4 结构之间的相互作用可能在选择性剪接机制中发挥至关重要的作用。
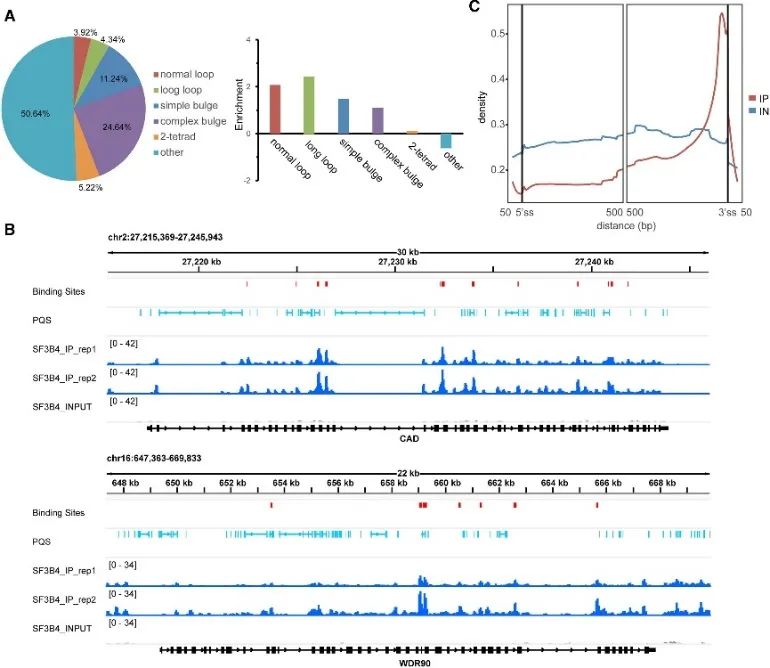
图 5 使用 eCLIP 技术确定了 SF3B4 在细胞中的 G4 结合偏好。
6. G4 结构调节 SF3B4 介导的选择性剪接。
作者对 SF3B4 结合位点进行了分析,揭示了其与 G4 结构的关联,并进一步研究了其在选择性剪接事件中的调控机制。筛选了涉及可变剪接的常规PQS,选择两个基因INPPL1和PPP6R2进行详细检查。确认了 INPPL1 和 PPP6R2 内的 G4 结构,称为 G4-INPPL1 和 G4-PPP6R2,并且 SF3B4 被鉴定为与这些 G4 结构特异性结合。此外,研究表明,添加 G4 配体吡啶他汀 (PDS) 会减少 SF3B4 与 G4 结构的结合,从而促进 INPPL1 和 PPP6R2 mRNA 剪接期间的外显子包含事件。这些发现表明 G4 结构在 SF3B4 介导的选择性剪接中的潜在重要性。
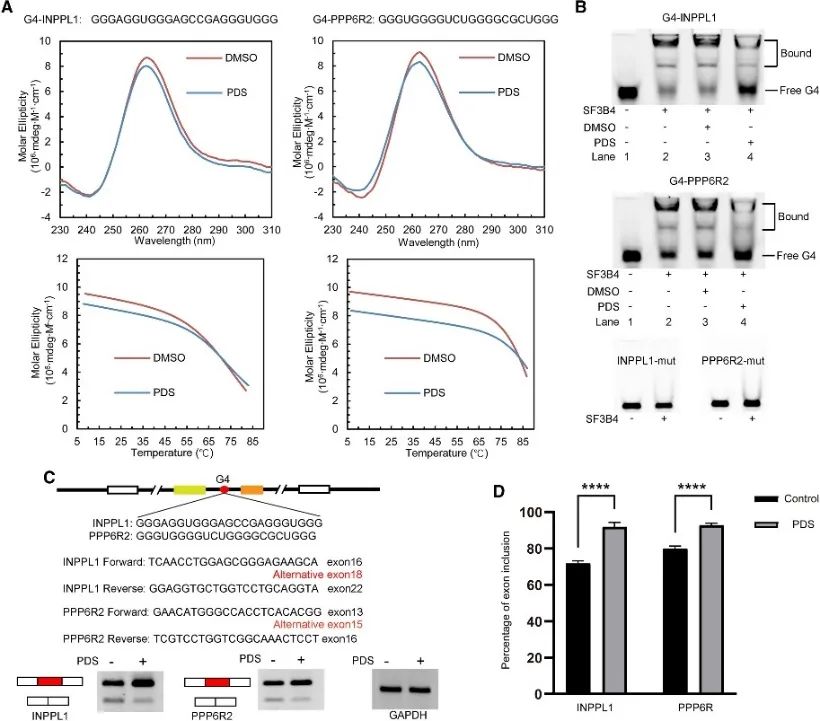
图6 SF3B4结合G4结构并影响mRNA的选择性剪接。
总之,本研究引入了一个包含 G4PID 探针和 PLGPB 策略的有效工具包,揭示了细胞内 G4 和蛋白质之间的相互作用如何影响基因表达,特别是影响选择性剪接的关键过程。这些发现加深了我们对G4在细胞生物学过程中的调控机制的理解,并为进一步探索G4相关疾病的治疗策略铺平了道路。

