揭开小分子 WA 的神秘面纱:揭示 PHGDH 酶调节并为新型抗癌疗法铺平道路
丝氨酸是一种不可或缺的氨基酸,在生物体内履行各种重要的生物学功能。它不仅是蛋白质合成的基本成分,还参与多种代谢途径的调节,包括核苷酸合成、蛋氨酸代谢和抗氧化功能。在这些途径中,磷酸丙酮酸脱氢酶 (PHGDH) 具有至关重要的意义,因为它催化丝氨酸合成途径的第一步,将 3-磷酸甘油酸转化为 3-磷酸羟基丙酮酸。鉴于其在丝氨酸代谢中的核心作用,PHGDH 功能的任何异常都与许多疾病(尤其是癌症)的发病和进展密切相关。
本文介绍了一种创新方法,利用化学蛋白质组学和表型分析技术来鉴定能够共价抑制 PHGDH 的化合物。虽然大多数 PHGDH 抑制剂在本质上通常具有竞争性,但作者提出了 Withangulatorin A (WA)(一种天然小分子)作为 PHGDH 的新型共价抑制剂。 WA 成为开发 PHGDH 抑制剂的一种有前途的先导化合物。此外,WA 作为研究 PHGDH 和丝氨酸合成途径 (SSP) 功能的有价值的探针。利用这种抑制剂,研究人员可以更深入地了解丝氨酸代谢的调节机制,从而为探索相关疾病(尤其是癌症)的潜在治疗方式开辟途径。
这一发现不仅为新型药物治疗策略的开发提供了有希望的方向,而且还为丝氨酸代谢在疾病进展中的作用提供了重要的见解。
研究路线
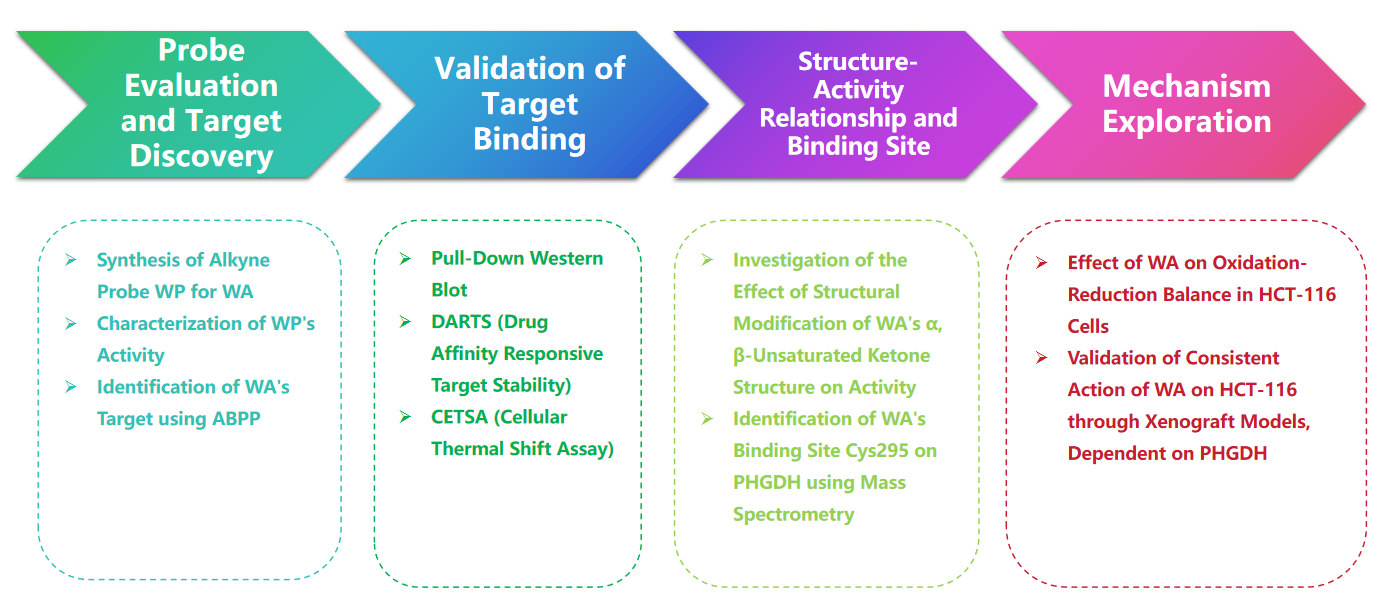
实验过程
1. WP和WA在细胞毒性实验中的比较。
在这项研究中,作者设计并合成了一种称为WP的复合探针。作者利用人类结肠癌细胞 (HCT-116) 和正常结肠细胞 (NCM460) 观察到 WP 表现出与 WA 相当的细胞毒性。这表明包含炔烃标记物并没有显着改变其细胞毒性作用。此外,作者指出,WA 在正常结肠细胞中表现出较低的细胞毒性,但在结肠癌细胞中表现出较高的细胞毒性,这强调了其对结肠癌细胞的选择性增强。
随后,作者采用了基于活性的蛋白质分析 (ABPP) 策略,在 HCT-116 细胞中利用 WP 探针。这种方法导致 PHGDH 被鉴定为 WA 的直接靶蛋白。使用 WB-pull down 测定进行实验验证,证实了研究结果。
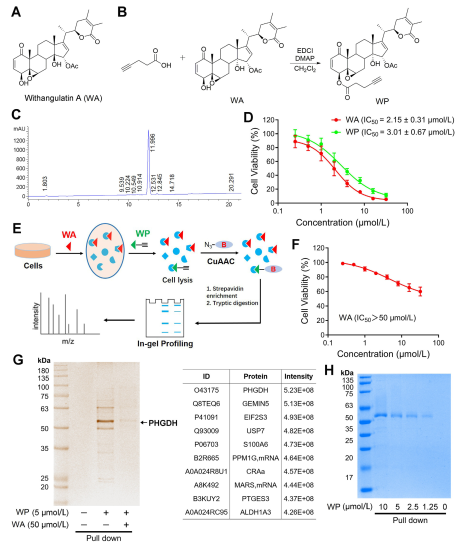
图 1:确定 Withangulatetin A 靶点的化学蛋白质组学方法。
2. 确认 WA 与 PHGDH 之间的直接互动。
利用基于活性的蛋白质分析 (ABPP) 技术,作者确定 PHGDH 是 HCT-116 细胞中化合物 WA 的直接靶标。为了验证 WA 和 PHGDH 之间的相互作用,作者进行了药物亲和力响应靶稳定性 (DARTS) 和细胞热位移测定 (CETSA) 实验。结果表明,WA增强了PHGDH的热稳定性并显着抑制其活性。此外,生物层干涉测量(BLI)实验进一步证实了 WA 和 PHGDH 之间的直接相互作用。
作者还研究了 WA 与 PHGDH 结合的不可逆性质。他们的实验表明,PHGDH 可以阻止 WP 结合;然而,用含有 N-乙酰半胱氨酸 (NAC) 或谷胱甘肽 (GSH) 的溶液预孵育可能会逆转 WP 与 PHGDH 的结合。这些发现表明 WA 和 PHGDH 蛋白中的半胱氨酸残基之间存在不可逆的共价结合。
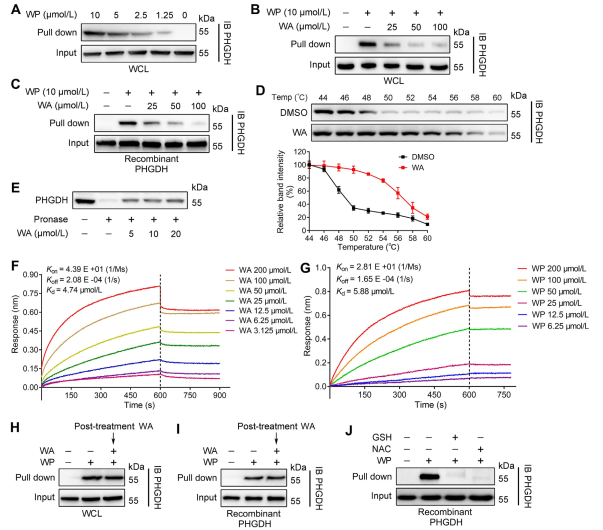
图 2:WA 直接结合 PHGDH。
3. WA通过α-β-不饱和酮部分与PHGDH共价结合。
为了进一步阐明WA与PHGDH相互作用的机制,研究人员进行了实验,证实WA通过其α-β-不饱和酮结构与PHGDH共价结合。最初,WA 的 α,β-不饱和酮片段被还原以产生 WA-1(参见部分图 3A)。随后使用细胞计数试剂盒-8 (CCK-8) 测定和 Pull-down 蛋白相互作用测定(参见图 3B)进行的分析表明,WA 的细胞毒性作用确实依赖于其 α 和 β-不饱和酮结构。相反,WA-1未能有效阻止PHGDH与WP的结合(参见图3C和D),从而进一步证实了β-不饱和酮与PHGDH的共价结合(参见图3E)。
鉴于 PHGDH 抑制或缺失在阻断肿瘤细胞丝氨酸合成途径 (SSP) 过程中的重要作用,作者继续使用 U-13C-葡萄糖稳定同位素标记研究 WA 对 HCT-116 细胞中 SSP 活性的影响(参见参见图 3J)。实验结果表明,WA有效抑制HCT-116细胞中的SSP活性。
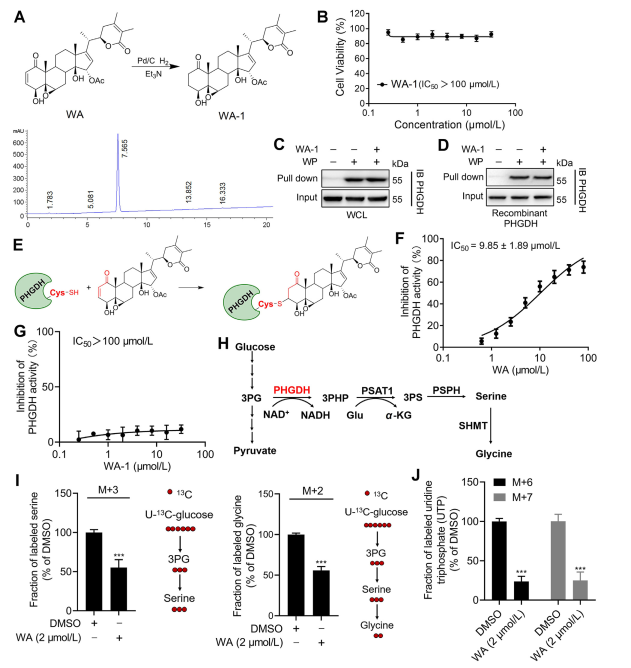
图 3:WA 与 PHGDH 共价结合并抑制 PHGDH 活性。
4. PHGDH 的 Cys295 残基与 WA 共价结合。
理论上,WA的α和β-不饱和酮部分可以与蛋白质的半胱氨酸残基形成共价键。事实上,作者观察到 WA 对 PHGDH 中 Cys295 残基的共价修饰。随后,他们提供了WA与PHGDH的Cys295残基共价结合的进一步证据,并证明Cys295处的突变显着降低了WA对PHGDH的抑制活性。此外,生物层干涉(BLI)实验显示WA和重组Cys295A PHGDH蛋白之间没有相互作用,证实了WA与PHGDH的选择性共价结合。
此外,分子动力学模拟表明,WA 作为 PHGDH 的变构调节剂发挥作用,其中 Cys295 残基可能作为 PHGDH 的新型变构位点。
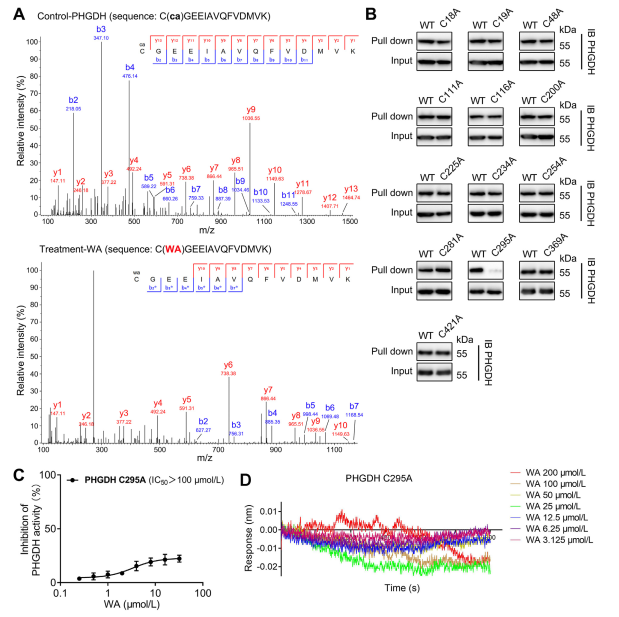
图 4. WA 选择性共价结合 PHGDH 的 Cys295 残基。
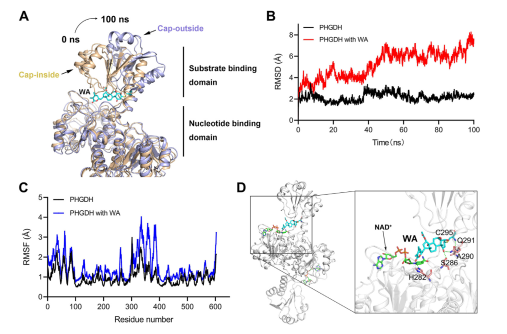
图 5:Cys295 残基作为 PHGDH 的变构调节位点
5. WA 对 HCT-116 细胞氧化还原平衡的影响。
丝氨酸合成途径 (SSP) 通过提供氧化还原反应必需的谷胱甘肽 (GSH) 合成和 NADPH 产生的前体,在维持细胞氧化还原平衡方面发挥着关键作用。作者研究了 WA 对 HCT-116 细胞氧化还原平衡的影响,并观察到 WA 导致活性氧 (ROS) 水平增加,从而降低 GSH/GSSG 和 NADPH/NADP+ 比率,表明氧化应激加剧。
Western blot 分析显示 γ H2AX、Cleaved caspase3 和 cleaved PARP 表达升高,同时 CHK2 和细胞周期蛋白 D1 表达降低,表明 WA 诱导细胞凋亡。此外,PHGDH 的缺失导致 ROS 产生增加,抑制 HCT-116 细胞的增殖,并降低 WA 在 PHGDH 表达低的细胞中的细胞毒性。这些发现强调了 PHGDH 在 HCT-116 细胞中 ROS 产生和 WA 介导的细胞毒性中的作用。
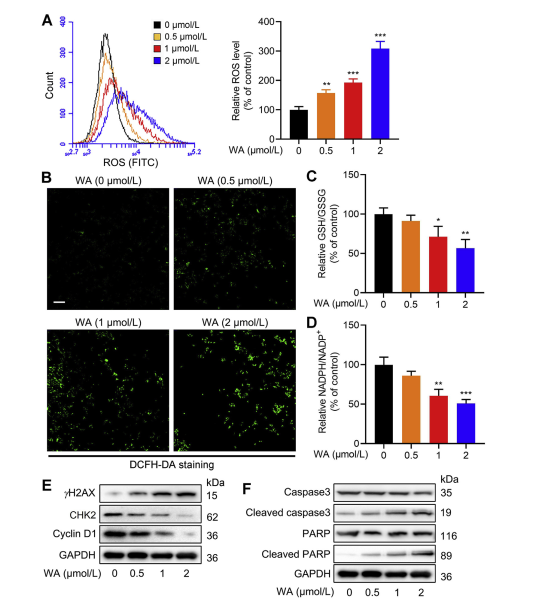
图 6:WA 增加 HCT-116 细胞的细胞内 ROS 水平
6. 异种移植模型中的细胞增殖效应。
为了评估 WA 对 HCT-116 细胞体内增殖的影响,作者使用 HCT-116 细胞建立了异种移植模型。结果表明,WA对体重或器官形态没有显着影响,表明毒性较低。
为了进一步研究 WA 对 PHGDH 抑制的选择性,作者使用 PHGDH 敲除 (KO) HCT116 细胞生成了异种移植模型。在此模型中,PHGDH 的缺失显着抑制 HCT-116 细胞增殖(参见图 7,AC)。此外,在 PHGDH KO HCT116 细胞异种移植模型中,细胞增殖标志物 Ki67 的表达显着降低(参见图 7,D)。
值得注意的是,在使用PHGDH KO HCT-116细胞的异种移植模型中,WA对细胞增殖没有明显的抑制作用(参见图7,EG),进一步证实WA对HCT-116细胞的抑制作用依赖于PHGDH。
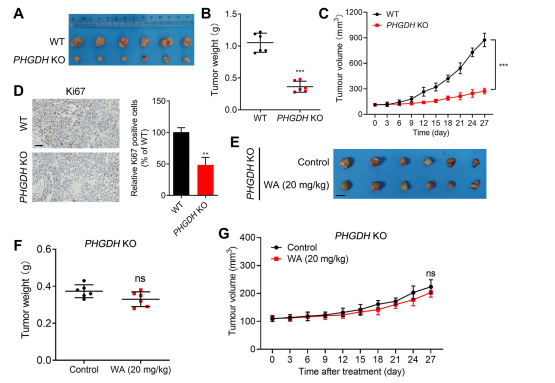
图7:WA对体内PHGDH KO HCT-116细胞增殖的影响
该研究结果不仅为PHGDH的未来抗癌药物开发提供了关键线索,也为癌症治疗领域的新药开发带来了新的希望和潜力。

